
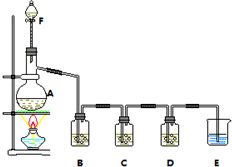
 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.分析 F中的浓盐酸滴入烧瓶A中的二氧化锰中发生反应生成氯气、二氧化锰、水,生成的氯气中含氯化氢、水蒸气,通过B中的饱和食盐水除去氯化氢,通过C中KI溶液
,探究Cl2与KI溶液的反应,通过D装置中AgNO3溶液生成氯化银白色沉淀,最后剩余氯气通过氢氧化钠溶液吸收,不能排放到空气中,防止污染空气,
(1)A中是制备氯气的装置,所以A是蒸馏烧瓶;B是用来除去氯气中的氯化氢气体,所以用饱和食盐水.
(2)氯气的KI溶液反应之后,剩余的氯气进入硝酸银溶液,生成氯化银白色沉淀;未反应的氯气进入氢氧化钠溶液被吸收.
(3)氯气开始进入C时,将碘离子氧化成单质碘,所以开始溶液变棕黄色;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,因为被置换出来的I2在KI溶液中溶解度、较大,所以溶液颜色逐渐加深,但随着反应KI被消耗,平衡I2(S)+I-?I3-(aq)向左移动,碘在水中的溶解度较小,所以部分碘以沉淀的形式析出.
(4)氯气过量时会将碘继续氧化成HIO3;Na2S2O3的物质的量=0.625×0.024=0.015mol,C中原I-的物质的量=0.005×0.5=0.0025mol,设被氯气氧化为x价,据反应I2+2S2O32-→2I-+S4O62-,得反应的碘单质物质的量=0.015×$\frac{1}{2}$=0.0075mol,碘原子共0.015mol,x价碘生成的占0.0025mol,则碘离子生成的为0.015-0.0025=0.0125mol,据化合价升降相等得:0.0025x=0.0125,x=5,所以碘元素的化合价为+5价.
(5)检验某溶液中是否含有I-,取样,滴加淀粉溶液,振荡均匀后再逐滴加入氯水并振荡.
解答 解:(1)A中是制备氯气的装置,依据仪器图形和用途可知A是蒸馏烧瓶,B中是用来除去氯气中的氯化氢气体,所以用饱和食盐水,
故答案为:蒸馏烧瓶,饱和食盐水;
(2)氯气的KI溶液反应之后,剩余的氯气进入硝酸银溶液,装置D中生成氯化银白色沉淀;未反应的氯气进入装置E中的氢氧化钠溶液被吸收,
故答案为:白色沉淀,吸收未反应的氯气;
(3)氯气开始进入C时,将碘离子氧化成单质碘,所以开始溶液变棕黄色;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,因为被置换出来的I2在KI溶液中溶解度、较大,所以溶液颜色逐渐加深,但随着反应KI被消耗,平衡I2(S)+I-?I3-(aq)向左移动,碘在水中的溶解度较小,所以部分碘以沉淀的形式析出,
故答案为:溶液变棕黄色,被置换出来的I2在KI溶液中溶解度、较大,所以溶液颜色逐渐加深,但随着反应KI被消耗,平衡I2(S)+I-?I3-(aq)向左移动,碘在水中的溶解度较小,所以部分碘以沉淀的形式析出;
(4)氯气过量时会将碘继续氧化成HIO3;Na2S2O3的物质的量=0.625×0.024=0.015mol,C中原I-的物质的量=0.005×0.5=0.0025mol,
设被氯气氧化为x价,据反应I2+2S2O32-→2I-+S4O62-,得反应的碘单质物质的量=0.015mol×$\frac{1}{2}$=0.0075mol,碘原子共0.015mol,
x价碘生成的占0.0025mol,则碘离子生成的为0.015-0.0025=0.0125mol,
据化合价升降相等得:0.0025x=0.0125,x=5,
所以碘元素的化合价为+5价,
故答案为:HIO3,+5;
(5)检验某溶液中是否含有I-,取样,滴加淀粉溶液,振荡均匀后再逐滴加入氯水并振荡,
故答案为:取样滴加淀粉溶液,振荡均匀后再逐滴加入氯水并振荡;
点评 本题考查了物质性质的实验设计过程分析判断,主要是氯气性质的理解应用,注意含碘物质中碘元素的化合价的确定和计算,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
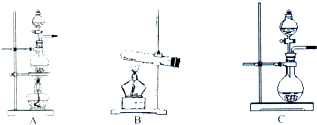 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2 的酯 | ||
| C. | 甲苯(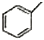 )的一氯代物 )的一氯代物 | D. | 立体烷(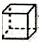 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )
,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m-1-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com