
| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
分析 A、氯化钠左调味剂,属于易溶于水的强电解质;
B、聚乙烯无毒,是食品保鲜膜、一次性食品袋的主要成分;
C、判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化;
D、铝合金的性能:强度大、质量轻、抗腐蚀能力强等.
解答 解:A、食盐可以作为调味剂,属于易溶于水的强电解质,也可以调节体液电解质平衡,故A正确;
B、聚乙烯无毒,是食品保鲜膜、一次性食品袋的主要成分,故B正确;
C、煤的干馏指煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程.有新的物质生成,属于化学变化,石油分馏是利用沸点不同使混合物分离的过程,没有新物质生成,属于物理变化,天然气生产甲醇属于化学变化,故C错误;
D、铝合金具有强度大、质量轻、抗腐蚀能力强等性能,在航空、航天、汽车、机械制造、船舶及化学工业中已大量应用,故D正确.
故选C.
点评 本题主要考查了生活的化学相关的知识,掌握物质的性质以及应用知识是解答的关键,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
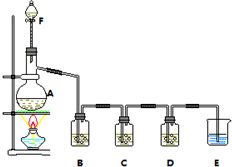 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | lmol该有机物可消耗3mol NaOH | B. | 该有机物的分子式为C16H1705 | ||
| C. | 最多可与7molH2发生加成 | D. | 苯环上的一溴代物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
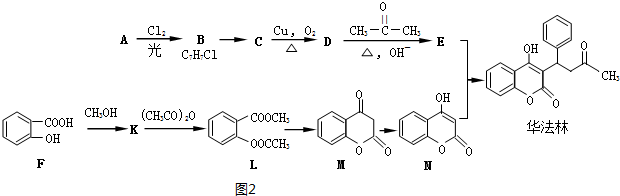
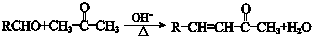
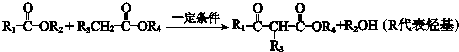
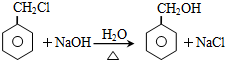 ;
;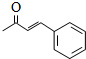 .L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
.L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
.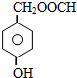 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
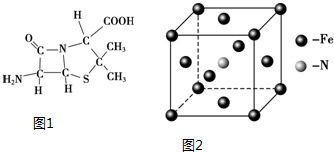
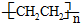 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
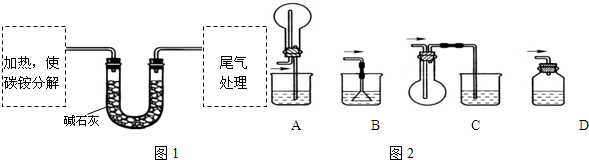
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油大体上是由各种碳氢化合物组成的混合物 | |
| B. | 石油分馏得到的各馏分是由各种碳氢化合物组成的混合物 | |
| C. | 石油裂解和裂化的主要目的都是为了得到重要产品乙烯 | |
| D. | 实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com