
【题目】钴镍渣是湿法炼锌净化渣之一,其中含有较多的Zn(II)、Cd(II)和少量Co(II)、Fe(II)、Ni(II)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:
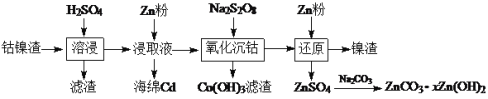
回答下列问题:
(1)“溶浸”时H2SO4的作用是_____________。
(2)向“浸取液”中加入Zn粉后发生反应的离子方程式为__________________。
(3)Na2S2O8中S的化合价为+6,其中过氧键的数目为________。
(4)研究加入Na2S2O8后温度和时间对金属脱除率的影响,所得曲线如下图所示。
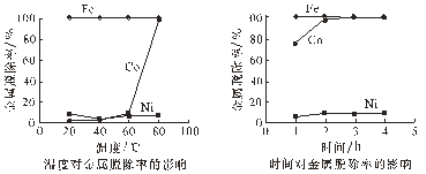
金属脱除是指溶液中的二价金属离子被氧化后形成氢氧化物沉淀而除去。由图可知,Co2+与Ni2+的还原性强弱关系是_________,“氧化沉钴”适宜的条件是________。
(5)在适宜的条件下,加入Na2S2O8并调节溶液pH至5.0~5.2,反应生成Co(OH)3的离子方程式为_______,Co(OH)3滤渣中还含有________。
(6)氧化锌是一种重要而且使用广泛的物理防晒剂,屏蔽紫外线的原理为吸收和散射。由ZnCO3·xZn(OH)2制备氧化锌的方法是__________。
【答案】溶解金属化合物(或使二价金属进入溶液) Zn+Cd2+ =Zn2++Cd 1 Co2+>Ni2+ 80℃,2h 2Co2++S2O82-+6H2O=2Co(OH)3↓+2SO42-+6H+ Fe(OH)3 高温焙烧
【解析】
钴镍渣加入稀硫酸进行酸浸,钴镍渣里面的硫酸盐及氢氧化物溶解在硫酸里,二价金属进入溶液,难溶的杂质经过滤除去,浸取液里加过量的锌粉,利用金属的活泼性不同将Cd置换出来,再加入强氧化剂Na2S2O8将溶液中的二价金属离子氧化为三价然后转化为氢氧化物沉淀除去,最后再加入锌粉经反应后过滤,将滤液中锌离子转化为沉淀ZnCO3·xZn(OH)2。根据以上分析解答。
(1) 钴镍渣加入稀硫酸进行酸浸,钴镍渣里面的硫酸盐及氢氧化物溶解在硫酸里,二价金属进入溶液,难溶的杂质经过滤除去。
答案为:溶解金属化合物(或使二价金属进入溶液)。
(2)向“浸取液”中加入Zn粉,根据题意可知得到了海绵Cd,发生反应的离子方程式为:Zn+Cd2+ =Zn2++Cd。
答案为:Zn+Cd2+ =Zn2++Cd。
(3)Na2S2O8中S的化合价为+6,Na为+1,假设含有x个O2-,含有y个O22-,则有:x+2y=8,(+1)2+(+6)2+(-2)x+(-2)y=0,解得x=6,y=1。
答案为:1。
(4)由题中所给图可知,当Co2+被氧化后形成氢氧化物沉淀而除去时,大量Ni2+还在溶液里,说明还原性Co2+>Ni2+,根据图中信息可知,当溶液中钴完全沉淀时的温度为80℃,所用时间为2h。
答案为:Co2+>Ni2+;80℃,2h 。
(5) 在适宜的条件下,加入Na2S2O8并调节溶液pH至5.0~5.2,Na2S2O8中S为+6价,具有强氧化性,可将Co2+氧化为+3价,生成Co(OH)3沉淀,根据溶液显弱酸性等相关信息,写出反应的离子方程式:2Co2++S2O82-+6H2O=2Co(OH)3↓+2SO42-+6H+,由Na2S2O8强氧化性及图中Co与Fe图象非常靠近的特征可知,此时溶液中的Fe2+也被氧化为+3价形成Fe(OH)3沉淀。
答案为:2Co2++S2O82-+6H2O=2Co(OH)3↓+2SO42-+6H+;Fe(OH)3 。
(6) ZnCO3·xZn(OH)2中的成分有难溶碳酸盐和难溶性碱,根据有关物质的性质可知这些物质受热后分解生成ZnO,工业上可用高温焙烧ZnCO3·xZn(OH)2的方法来制取氧化锌。
答案为:高温焙烧


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、CO32-、S2-、SO32-、SO42-。现取该溶液进行有关实验,实验过程及现象如图所示:

下列说法不正确的是
A.根据实验①中的现象可推出,淡黄色沉淀一定不是AgBr
B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有AlO2-
C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,则下列有关说法正确的是
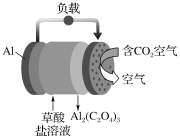
A.以此电池为电源电解精炼铜,当有0.1 mol 电子转移时,有3.2 g铜溶解
B.正极每消耗4.48L的CO2,则生成0.1molC2O42-
C.每生成1 mol Al2(C2O4)3,有6 mol电子流过草酸盐溶液
D.随着反应进行,草酸盐浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备![]() 纳米颗粒的反应是
纳米颗粒的反应是![]() ,关于该反应下列说法中正确的是( )
,关于该反应下列说法中正确的是( )
A.H2O和S4O62-都是还原产物B.![]() 和
和![]() 都是还原剂
都是还原剂
C.![]() 被氧化时,转移
被氧化时,转移![]() 电子D.
电子D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答有关问题:
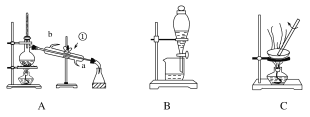
(1)装置A中玻璃仪器①的名称是________,进水的方向是从____口(填字母)进水。
(2)利用装置B分液时为使液体顺利滴下,应进行的具体操作是_________________。
(3)从氯化钾溶液中得到氯化钾固体,应选择装置________(填字母,下同);从碘水中分离出I2,应选择装置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究柠檬电池的工作原理时,某课外小组同学发现:当按图Ⅰ所示连接一个柠檬时,二极管不发光;按图Ⅱ所示连接几个柠檬时,二极管发光。下列说法不正确的是

A. 图Ⅰ中二极管不发光,说明该装置不构成原电池
B. 图Ⅱ中铁环为负极、铜线为正极,负极的电极反应为:Fe-2 e-===Fe2+
C. 图Ⅰ中二极管不发光的原因是单个柠檬电池的电压较小
D. 图Ⅱ中所得的电池组的总电压是各个柠檬电池的电压之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH![]() CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。
请你回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是___________________。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是________,它与溴水反应的化学方程式是_________________。在验证过程中必须全部除去。为此,乙同学设计了如图所示的实验装置:
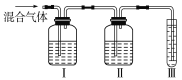
请回答:Ⅰ、Ⅱ、Ⅲ装置中可盛放的试剂是:Ⅰ________、Ⅱ________、Ⅲ________(填序号)。
A.品红 B.NaOH溶液
C.溴水 D.酸性高锰酸钾溶液
(3)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学画出的基态氮原子核外电子排布图。下列判断正确的是( )
![]()
A. 正确,符合核外电子排布规律B. 错误,违背了“能量最低原理”
C. 错误,违背了“泡利原理”D. 错误,违背了“洪特规则”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别调节浓度均为0.1 mol·L-1 HA溶液、HB的溶液的pH,所得溶液中酸分子的百分含量ω%(如HA的百分含量为![]() ×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
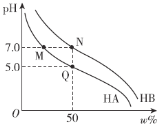
A.常温下,Ka(HA)=1.0×10-5B.M、N两点对应离子浓度:c(A-)=c(B-)
C.将M、N两点溶液等体积混合,溶液呈中性D.水的电离程度:M=N>Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com