
【题目】下列说法或表示方法正确的是
A.S(g)+O2(g)=SO2(g) △H1, S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2。
B.由C(石墨)=C(金刚石) ΔH=+119kJ·mol-1可知,金刚石比石墨稳定。
C.在稀溶液中:H+(aq)+OH-(aq) ===H2O(l);ΔH=-57.3kJ·mol-1,若将含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量等于57.3kJ。
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) ===2H2O(l);ΔH=-571.6kJ·mol-1。
【答案】D
【解析】
A.硫燃烧是放热反应,△H1、△H2均小于0,同质量的固体硫燃烧比硫蒸气燃烧放出的热量少,即![]() ,则△H1<△H2,A项错误;
,则△H1<△H2,A项错误;
B.由反应C(石墨)=C(金刚石) ΔH=+119kJ·mol-1可知,反应为吸热反应,金刚石具有的能量高于石墨,物质能量越高,越不稳定,故金刚石不如石墨稳定,B项错误;
C.CH3COOH为弱酸,与NaOH发生反应的过程中,会因CH3COOH的电离而吸热,使得测得的中和热的数值偏低,其放出的热量小于57.3kJ,C项错误;
D.2g H2的物质的量是1mol,燃烧生成液态水放出285.8kJ热量,则2mol H2完全燃烧生成液态水放出的热量为![]() ,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) ===2H2O(l);ΔH=-571.6kJ·mol-1,表述正确,D项正确;
,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) ===2H2O(l);ΔH=-571.6kJ·mol-1,表述正确,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 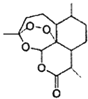 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
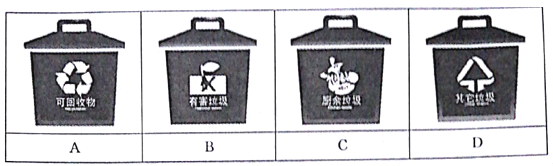
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
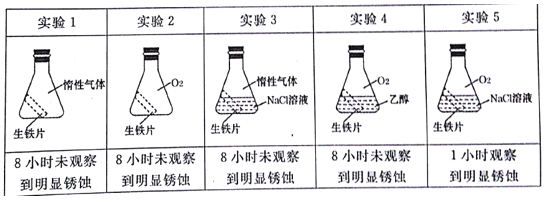
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
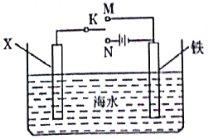
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝混合物进行如下实验:
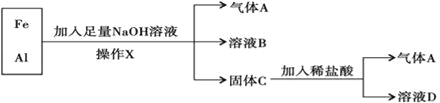
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往20ml1mol/L的AlCl3溶液中滴加0.2mol/L的NaOH溶液,最后有1.17克沉淀生成,则加入NaOH溶液的体积是
A.125mLB.275mLC.325mLD.450mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,用还原铜粉和氯气来制备氯化铜。已知:氯化铜容易潮解。氯化亚铜微溶于水,不溶于稀盐酸和酒精。
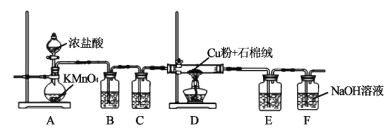
(1)装置A中发生反应的化学方程式为___。
(2)B装置的作用是___;C装置中的试剂是___;E装置的作用是___;F装置中可能发生的化学反应的离子方程式为___。
(3)当Cl2排尽空气后,加热D。装置D中的现象是___。
(4)另取CuCl2固体用于制备CuCl。将CuCl2固体溶解在适量蒸馏水中,并加入少量稀盐酸,然后向溶液中通入SO2气体并加热可得到CuCl白色沉淀,过滤、洗涤、干燥,即得CuCl晶体。
①制备CuCl反应的离子方程式为___;
②洗涤时,先用稀盐酸洗涤数次,后用酒精漂洗,用酒精漂洗的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素 A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的 2 倍。 B在 D中充分燃烧能生成其最高价化合物 BD2。E+与D2-具有相同的电子数。 A 在 F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是____________,写出单质 F和NaOH的离子方程式____________。
(2)B、D、E 组成的一种盐中, E的质量分数为43%,其俗名为________ ,其水溶液与等物质的量的 F单质反应的化学方程式为___________________;
(3)由这些元素组成的物质,其组成和结构信息如下表:

a的化学式为_______;b与水反应的化学方程式为_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有 Cr2O72-,为了处理有毒的 Cr2O72-,需要先测定其浓度:取 20 mL 废水,加入适量稀硫酸, 再加入过量的 V1 mL c1 mol·L-1(NH4)2Fe(SO4)2 溶液,充分反应(还原产物为 Cr3+)。用 c2 mol·L-1KMnO4 溶液滴定过量的 Fe2+至终点,消耗 KMnO4 溶液 V2 mL。则原废水中 c(Cr2O72-)为(用代数式表示)
A.![]() mol·L-1
mol·L-1
B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1
mol·L-1
D.![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com