
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,用还原铜粉和氯气来制备氯化铜。已知:氯化铜容易潮解。氯化亚铜微溶于水,不溶于稀盐酸和酒精。
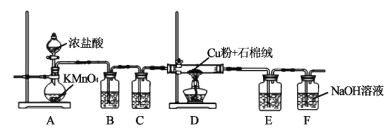
(1)装置A中发生反应的化学方程式为___。
(2)B装置的作用是___;C装置中的试剂是___;E装置的作用是___;F装置中可能发生的化学反应的离子方程式为___。
(3)当Cl2排尽空气后,加热D。装置D中的现象是___。
(4)另取CuCl2固体用于制备CuCl。将CuCl2固体溶解在适量蒸馏水中,并加入少量稀盐酸,然后向溶液中通入SO2气体并加热可得到CuCl白色沉淀,过滤、洗涤、干燥,即得CuCl晶体。
①制备CuCl反应的离子方程式为___;
②洗涤时,先用稀盐酸洗涤数次,后用酒精漂洗,用酒精漂洗的目的是___。
【答案】2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 除去氯气中混有的氯化氢气体 浓硫酸 防止CuCl2潮解 Cl2+2OH-=Cl-+ClO-+H2O 产生棕黄色的烟 2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42- 洗去CuCl沉淀表面的杂质,减少CuCl溶解损耗,有利于干燥
2CuCl↓+4H++SO42- 洗去CuCl沉淀表面的杂质,减少CuCl溶解损耗,有利于干燥
【解析】
装置A制备氯气,浓盐酸易挥发,所以氯气中含有少量氯化氢气体和水蒸气,需处理,否则会造成CuCl2的水解。CuCl2易潮解,E装置的作用得防止F中的水蒸气进入D装置而引起CuCl2水解。氯气有毒,不能直接排放到空气中。据此解答。
(1)KMnO4的氧化性强于MnO2,故在常温下能与浓盐酸反应产生Cl2,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)该反应为放热反应,浓盐酸易挥发,故生成的氯气中含有少量氯化氢气体,利用氯化氢极易溶于水,而氯气难溶于饱和食盐水,可用饱和食盐水将氯气中混有的氯化氢除去,故装置B的作用是除去氯气中混有的氯化氢气体。C装置中的试剂是浓硫酸,作用是干燥氯气。CuCl2易潮解,E装置中盛有浓硫酸,可防止F中的水蒸气进入D装置而引起CuCl2水解。氯气有毒,不能直接排放到空气中,F装置的作用是吸收未反应的氯气,反应的离子方程式为:Cl2+2OH- =Cl-+ClO-+H2O。答案为:除去氯气中混有的氯化氢气体;浓硫酸;防止CuCl2潮解;Cl2+2OH-=Cl-+ClO-+H2O;
(3)当Cl2排尽空气后,加热D,发生的反应为Cu+Cl2![]() CuCl2,现象是产生棕黄色的烟。答案为:产生棕黄色的烟;
CuCl2,现象是产生棕黄色的烟。答案为:产生棕黄色的烟;
(4)①CuCl2溶液与SO2发生氧化还原反应,生成CuCl沉淀和H2SO4,离子方程式为:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-。答案为:2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-。答案为:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-;
2CuCl↓+4H++SO42-;
②CuCl微溶于水,不溶于稀盐酸和酒精,且酒精易挥发,故用酒精漂洗可洗去CuCl沉淀表面的杂质,减少CuCl溶解损耗,有利于干燥。答案为:洗去CuCl沉淀表面的杂质,减少CuCl溶解损耗,有利于干燥。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。下列说法不正确的是
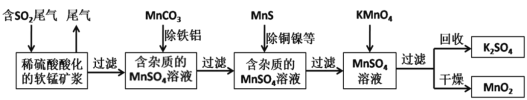
A.上述流程中多次涉及到过滤操作,实验室进行过滤操作时需用到的硅酸盐材质仪器有:玻璃棒、烧杯、漏斗
B.用MnCO3能除去溶液中的Al3+和Fe3+,其原因是MnCO3消耗了溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
C.实验室用一定量的NaOH溶液和酚酞试液就可以准确测定燃煤尾气中的SO2含量
D.MnSO4溶液→MnO2过程中,应控制溶液pH不能太小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学化学反应原理,解决以下问题:
(1)请用离子方程式表示泡沫灭火器的工作原理___。
(2)请用离子方程式解释漂白粉和洁厕灵不能混合使用的原因___。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,写出该过程的离子方程式___。
(4)用CO(g)还原80gFe2O3(s)生成Fe(s)和CO2(g),放热12.4kJ,请写出该反应的热化学方程式___。
(5)已知2CO(g)![]() CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,盐桥中装有琼脂与饱和K2SO4溶液,已知,氧化性:Cr2O72->Fe3+,下列叙述中不正确的是( )
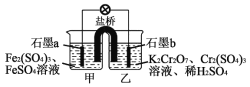
A.a电极为负极,b电极为正极
B.外电路中电子移动的方向:a极→导线→b极
C.电池工作时,盐桥中的K+移向甲烧杯
D.乙烧杯中发生的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.S(g)+O2(g)=SO2(g) △H1, S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2。
B.由C(石墨)=C(金刚石) ΔH=+119kJ·mol-1可知,金刚石比石墨稳定。
C.在稀溶液中:H+(aq)+OH-(aq) ===H2O(l);ΔH=-57.3kJ·mol-1,若将含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量等于57.3kJ。
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) ===2H2O(l);ΔH=-571.6kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐: 0.7molKCl、0.2molKClO和X。则X是
A. 0.1molKClO4 B. 0.1molKClO3
C. 0.2molKClO2 D. 0.1molKClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com