
【题目】根据所学化学反应原理,解决以下问题:
(1)请用离子方程式表示泡沫灭火器的工作原理___。
(2)请用离子方程式解释漂白粉和洁厕灵不能混合使用的原因___。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,写出该过程的离子方程式___。
(4)用CO(g)还原80gFe2O3(s)生成Fe(s)和CO2(g),放热12.4kJ,请写出该反应的热化学方程式___。
(5)已知2CO(g)![]() CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
【答案】Al3++3HCO3-=Al(OH)3↓+3CO2↑ ClO-+Cl-+2H+=Cl2↑+H2O ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH=-24.8kJ·mol-1 CO
【解析】
(1)泡沫灭火器的主要成分硫酸铝和碳酸氢钠,二者水解相互促进,工作原理用离子方程式表示:Al3++3HCO3-=Al(OH)3↓+3CO2↑。
(2)漂白粉次氯酸钙和洁厕灵稀盐酸不能混合使用的原因是因为二者发生氧化还原反应生成氯气:ClO-+Cl-+2H+=Cl2↑+H2O。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,发生沉淀的转换,该过程的离子方程式为ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)。
(4)80gFe2O3为0.5mol,则1mol氧化铁反应放热为24.8 kJ,该反应的热化学方程式3CO(g)+Fe2O3(g)=3CO2(g)+2Fe(s) ΔH=-24.8kJ·mol-1。
(5)已知2CO(g)![]() CO2(g)+C(s) △H<0,T=980K时,△H-T△S=0,因△H和△S值不变,且△S<0,体系温度低于980 K时,△H-T△S<0,反应能自发进行,当体系温度高于980 K时,△H-T△S>0,逆反应自发进行,故温度高于980 K时C的氧化产物主要是以CO为主。
CO2(g)+C(s) △H<0,T=980K时,△H-T△S=0,因△H和△S值不变,且△S<0,体系温度低于980 K时,△H-T△S<0,反应能自发进行,当体系温度高于980 K时,△H-T△S>0,逆反应自发进行,故温度高于980 K时C的氧化产物主要是以CO为主。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
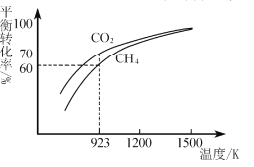
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
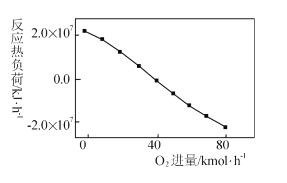
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
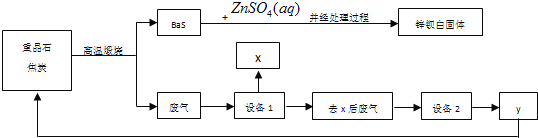
请根据上述流程回答下列问题:
(1)重晶石的化学式为_______,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程![]() 的步骤为:①_________;②洗涤;③______________。
的步骤为:①_________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是__________________________________。
(4)检验锌钡白中含有S2-的方法是________________________________________。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为________。写出设备2中发生反应的离子方程式:___________________________________、_________________________________。
(6)可用_______法分离溶液中的钠盐,进行分离前,需要查得的是______________________。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为___________(至少写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO310H2O的质量为_______ g(保留2位小数)。
(2)CoCl2xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
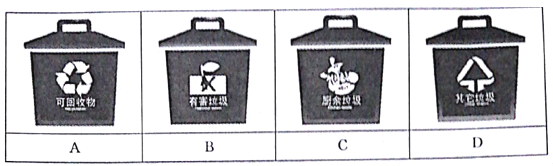
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
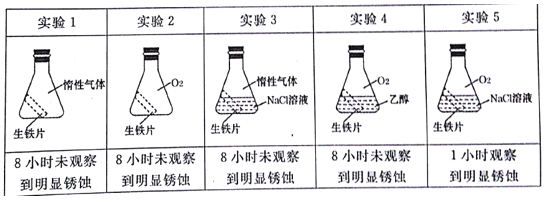
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
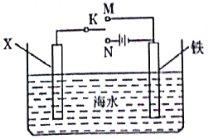
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁酸-3-苯丙酯( )是一种香料,下图是这种香料的一种合成路线:
)是一种香料,下图是这种香料的一种合成路线:

已知以下信息:
①有机物E的摩尔质量为88 g·mol-1,其核磁共振氢谱表明含有3种不同环境的氢原子。
②有机物F是苯甲醇的同系物。
③R—CH==CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)异丁酸-3-苯丙酯的分子式为________________。
(2)A分子中的官能团名称为________________。
(3)C的结构简式为________________。
(4)一定条件下,1 mol D与2 mol H2能够完全反应生成F,D能够发生银镜反应,因此D生成F的反应类型为________________。
(5)E、F反应生成异丁酸-3-苯丙酯的化学方程式为________________________。
(6)已知有机化合物甲符合下列条件:
①与F是同分异构体;②苯环上有3个支链;③核磁共振氢谱显示其含有5种不同环境的氢原子,且不同环境的氢原子个数比为6∶2∶2∶1∶1;④与FeCl3溶液不能发生显色反应。
写出符合上述条件的有机物甲的结构简式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝混合物进行如下实验:
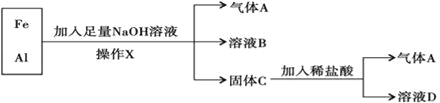
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,用还原铜粉和氯气来制备氯化铜。已知:氯化铜容易潮解。氯化亚铜微溶于水,不溶于稀盐酸和酒精。
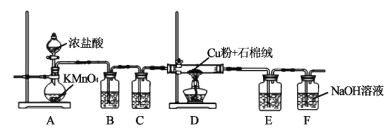
(1)装置A中发生反应的化学方程式为___。
(2)B装置的作用是___;C装置中的试剂是___;E装置的作用是___;F装置中可能发生的化学反应的离子方程式为___。
(3)当Cl2排尽空气后,加热D。装置D中的现象是___。
(4)另取CuCl2固体用于制备CuCl。将CuCl2固体溶解在适量蒸馏水中,并加入少量稀盐酸,然后向溶液中通入SO2气体并加热可得到CuCl白色沉淀,过滤、洗涤、干燥,即得CuCl晶体。
①制备CuCl反应的离子方程式为___;
②洗涤时,先用稀盐酸洗涤数次,后用酒精漂洗,用酒精漂洗的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com