
【题目】CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO310H2O的质量为_______ g(保留2位小数)。
(2)CoCl2xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________。
【答案】5.72 6 Co2O3
【解析】
(1)滤液与洗涤液与盐酸反应生成气体是因为溶液中有过量的Na2CO3,Na2CO3+2HCl =2NaCl +CO2 ↑+H2O,n(Na2CO3)=![]() ==0.01mol,CoCO3的物质的量:
==0.01mol,CoCO3的物质的量:![]() =0.01mol,所以根据CO32-守恒可知总Na2CO3·10H2O的物质的量是0.01mol+0.01mol=0.02mol,固体混合物中Na2CO310H2O的质量为286g·mol-1×0.02mol=5.72g;
=0.01mol,所以根据CO32-守恒可知总Na2CO3·10H2O的物质的量是0.01mol+0.01mol=0.02mol,固体混合物中Na2CO310H2O的质量为286g·mol-1×0.02mol=5.72g;
故答案为:5.72g;
(2)CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,(59+71+18x)×0.01mol+5.72g=8.100g,x=6;
故答案为:6;
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,其中n(Co)=0.01mol,n(O)=![]() =0.015mol,n(Co):n(O)=2:3,该氧化物属离子晶体,该晶体的化学式为Co2O3;
=0.015mol,n(Co):n(O)=2:3,该氧化物属离子晶体,该晶体的化学式为Co2O3;
故答案为:Co2O3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
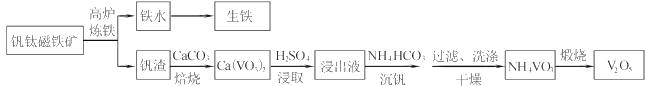
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
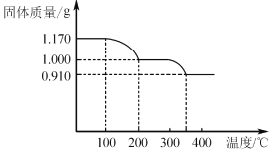
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。下列说法不正确的是
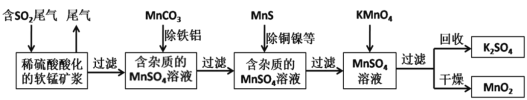
A.上述流程中多次涉及到过滤操作,实验室进行过滤操作时需用到的硅酸盐材质仪器有:玻璃棒、烧杯、漏斗
B.用MnCO3能除去溶液中的Al3+和Fe3+,其原因是MnCO3消耗了溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
C.实验室用一定量的NaOH溶液和酚酞试液就可以准确测定燃煤尾气中的SO2含量
D.MnSO4溶液→MnO2过程中,应控制溶液pH不能太小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2S 溶液逐滴加入等物质的量浓度的FeCl3溶液中,发生反应:2Fe3+ + S2- → 2Fe2+ + S ↓;将FeCl3溶液逐滴加入等物质的量浓度的Na2S溶液中,发生反应:2Fe3+ + 3S2- → Fe2S3↓ 。则以下叙述错误的是
A.Fe3+在酸性环境中氧化性较强B.S2-在碱性环境中还原性较强
C.相同温度下Fe(OH)3的溶解度比Fe2S3大D.往FeCl3溶液中通入H2S,有硫析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入铝粉能放出氢气的溶液:Na+、Mg2+、Cl-、NO3-;
B.由水电离出的c(OH-)=1.0×10-12mol·L-1的溶液:Fe2+、NH4+、ClO-、SO42-
C.![]() =1.0×10-12的溶液:K+、SO32-、S2-、Cl-
=1.0×10-12的溶液:K+、SO32-、S2-、Cl-
D.c(NH4+)=c(Cl-)的NH4Cl-NH3·H2O混合液:Al3+、Fe3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1的H2B溶液中滴加0.2mol·L-1的NaOH溶液过程中,有关微粒的物质的量变化如图所示,下列说法不正确的是( )

A.I表示H2B,Ⅱ代表HB-、Ⅲ代表B2-
B.当c(Na+)=2c(B2-)+c(HB-)时,溶液呈中性
C.初始时H2B第一级电离的电离度为90%
D.V(NaOH)=20mL时:c(Na+)>c(HB-)>c(B2-)>c(H2B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学化学反应原理,解决以下问题:
(1)请用离子方程式表示泡沫灭火器的工作原理___。
(2)请用离子方程式解释漂白粉和洁厕灵不能混合使用的原因___。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,写出该过程的离子方程式___。
(4)用CO(g)还原80gFe2O3(s)生成Fe(s)和CO2(g),放热12.4kJ,请写出该反应的热化学方程式___。
(5)已知2CO(g)![]() CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,盐桥中装有琼脂与饱和K2SO4溶液,已知,氧化性:Cr2O72->Fe3+,下列叙述中不正确的是( )
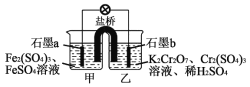
A.a电极为负极,b电极为正极
B.外电路中电子移动的方向:a极→导线→b极
C.电池工作时,盐桥中的K+移向甲烧杯
D.乙烧杯中发生的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com