
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入铝粉能放出氢气的溶液:Na+、Mg2+、Cl-、NO3-;
B.由水电离出的c(OH-)=1.0×10-12mol·L-1的溶液:Fe2+、NH4+、ClO-、SO42-
C.![]() =1.0×10-12的溶液:K+、SO32-、S2-、Cl-
=1.0×10-12的溶液:K+、SO32-、S2-、Cl-
D.c(NH4+)=c(Cl-)的NH4Cl-NH3·H2O混合液:Al3+、Fe3+、SO42-、HCO3-
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_______。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。
①肼的电子式___________。
②64.0克肼在氧气中完全燃烧生成氮气和液态水放出热量1248kJ(在101kPa,25℃),则表示肼燃烧热的热化学方程式为________________________________________。
(3)工业合成氨的反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
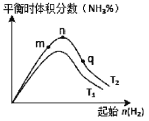
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是__________点。
②图像中T2______T1(填“高于”、“低于”、“等于”或“无法确定”),理由是____________。
③在绝热容器中进行该反应时,压缩容器体积,平衡常数__________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 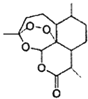 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
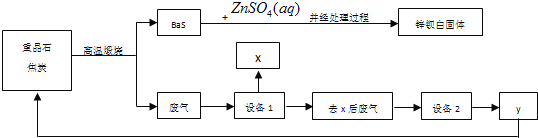
请根据上述流程回答下列问题:
(1)重晶石的化学式为_______,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程![]() 的步骤为:①_________;②洗涤;③______________。
的步骤为:①_________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是__________________________________。
(4)检验锌钡白中含有S2-的方法是________________________________________。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为________。写出设备2中发生反应的离子方程式:___________________________________、_________________________________。
(6)可用_______法分离溶液中的钠盐,进行分离前,需要查得的是______________________。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为___________(至少写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为150mL
D.溶解合金时收集到NO气体的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO310H2O的质量为_______ g(保留2位小数)。
(2)CoCl2xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
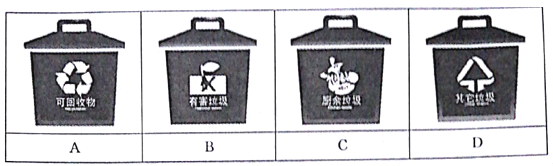
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
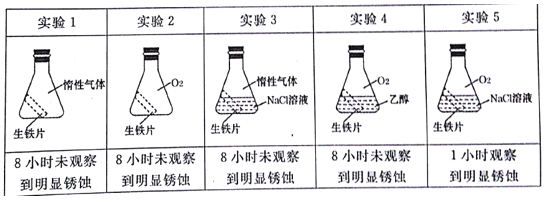
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
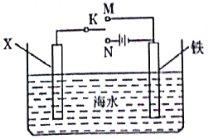
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝混合物进行如下实验:
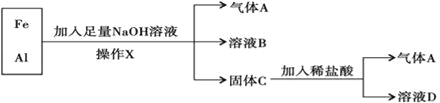
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素 A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的 2 倍。 B在 D中充分燃烧能生成其最高价化合物 BD2。E+与D2-具有相同的电子数。 A 在 F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是____________,写出单质 F和NaOH的离子方程式____________。
(2)B、D、E 组成的一种盐中, E的质量分数为43%,其俗名为________ ,其水溶液与等物质的量的 F单质反应的化学方程式为___________________;
(3)由这些元素组成的物质,其组成和结构信息如下表:

a的化学式为_______;b与水反应的化学方程式为_______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com