
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
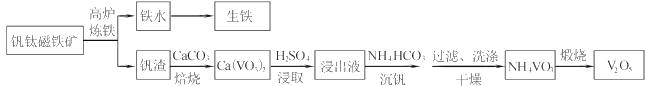
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
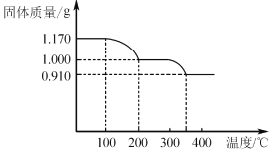
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
【答案】B V2O3+O2+CaCO3![]() Ca(VO3)2+CO2 加入硫酸使VO3-+2H+
Ca(VO3)2+CO2 加入硫酸使VO3-+2H+![]() VO2++H2O中c(VO3-)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)
VO2++H2O中c(VO3-)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)![]() Ca2+(aq)+VO3-(aq)正向移动,Ca(VO3)2溶解 (VO2)2SO4 NH4++2HCO3-+VO2+=NH4VO3↓+2CO2↑+H2O NH4VO3不溶于乙醇,减少损失 HVO3 H2O
Ca2+(aq)+VO3-(aq)正向移动,Ca(VO3)2溶解 (VO2)2SO4 NH4++2HCO3-+VO2+=NH4VO3↓+2CO2↑+H2O NH4VO3不溶于乙醇,减少损失 HVO3 H2O
【解析】
(1)从高炉炼铁的反应解答;
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,可看到钒元素化合价升高了,找氧化剂并用氧化还原反应原理来书写该反应的化学方程式;
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析;找到浸出液中含钒的微粒,即可写出物质的化学式;
(4)分析浸出液中含钒微粒与碳酸氢铵之间的反应,结合沉钒过程有气体生成来书写其反应的离子方程式;
(5)比较乙醇、水分别作洗涤剂洗涤沉淀优劣,就可找出原因;
(6)由图示数据等信息、结合物质的性质计算求解;
(1)高炉炼铁的主要原理是Fe2O3+3CO![]() 2Fe+3CO2,因此应用的冶炼方法是热还原法;答案为:B;
2Fe+3CO2,因此应用的冶炼方法是热还原法;答案为:B;
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,可看到钒元素化合价升高了,但是焙烧时加入CaCO3并不是氧化剂,真正的氧化剂是氧气,故该反应的化学方程式为V2O3+O2+CaCO3![]() Ca(VO3)2+CO2;答案为:V2O3+O2+CaCO3
Ca(VO3)2+CO2;答案为:V2O3+O2+CaCO3![]() Ca(VO3)2+CO2;
Ca(VO3)2+CO2;
(3)Ca(VO3)2难溶于水,则存在溶解平衡:![]() ,又有信息知
,又有信息知![]() ,故可推知Ca(VO3)2难溶于水但能溶于稀硫酸,氢离子浓度增大,
,故可推知Ca(VO3)2难溶于水但能溶于稀硫酸,氢离子浓度增大,![]() 向右移动,
向右移动,![]() 浓度减小,
浓度减小,![]() 向右移动;
向右移动;
答案为:加入硫酸,![]() 中c(VO3-)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)
中c(VO3-)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)![]() Ca2+(aq)+VO3-(aq)正向移动,Ca(VO3)2溶解;上述平衡移动的结果,浸出液中含钒粒子主要为
Ca2+(aq)+VO3-(aq)正向移动,Ca(VO3)2溶解;上述平衡移动的结果,浸出液中含钒粒子主要为![]() ,则含钒物质的化学式为(VO2)2SO4;答案为:(VO2)2SO4;
,则含钒物质的化学式为(VO2)2SO4;答案为:(VO2)2SO4;
(4)浸出液中含钒粒子主要为![]() ,加入碳酸氢铵通过反应沉钒,沉钒过程有气体生成,气体只能是CO2,沉钒结果得到NH4VO3;可以看到加入碳酸氢铵,碳酸氢根消耗氢离子使
,加入碳酸氢铵通过反应沉钒,沉钒过程有气体生成,气体只能是CO2,沉钒结果得到NH4VO3;可以看到加入碳酸氢铵,碳酸氢根消耗氢离子使![]() 平衡向左移动,
平衡向左移动,![]() 浓度减小,以及
浓度减小,以及![]() 与铵根离子产生沉淀可使反应持续进行,故沉钒过程的离子方程式为NH4++2HCO3-+VO2+=NH4VO3↓+2CO2↑+H2O;答案为:NH4++2HCO3-+VO2+=NH4VO3↓+2CO2↑+H2O;
与铵根离子产生沉淀可使反应持续进行,故沉钒过程的离子方程式为NH4++2HCO3-+VO2+=NH4VO3↓+2CO2↑+H2O;答案为:NH4++2HCO3-+VO2+=NH4VO3↓+2CO2↑+H2O;
(5)题给信息②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇,因此过滤后用乙醇代替水来洗涤沉淀的原因是NH4VO3不溶于乙醇,减少损失;答案为:NH4VO3不溶于乙醇,减少损失;
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,质量减少0.17g,所以0.01molNH4VO3,生成气体为氨气0.01mol,发生NH4VO3![]() NH3↑+HVO3,失去的是氨气,得到的是HVO3;答案为:HVO3;
NH3↑+HVO3,失去的是氨气,得到的是HVO3;答案为:HVO3;
加热到350℃时固体质量减少0.09g,失去0.005molH2O,发生的反应2HVO3![]() H2O+V2O5;答案为:H2O。
H2O+V2O5;答案为:H2O。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
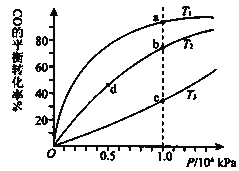
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )
A.所有原子可能在同一平面上
B.所有原子可能在同一条直线上
C.所有碳原子可能在同一平面上
D.处在同一平面上的原子最多有20个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机合成中间体,它的合成路线如图:
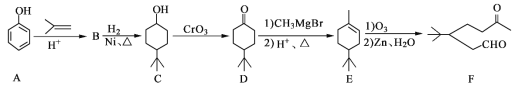
(1)化合物F中含氧官能团的名称是______和______,由A生成B的化学反应类型是______;
(2)写出化合物B的结构简式:______;
(3)写出化合物C与乙酸反应生成酯的化学方程式:______;
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:______(任写一种);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_______。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。
①肼的电子式___________。
②64.0克肼在氧气中完全燃烧生成氮气和液态水放出热量1248kJ(在101kPa,25℃),则表示肼燃烧热的热化学方程式为________________________________________。
(3)工业合成氨的反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
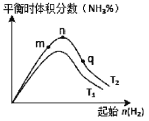
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是__________点。
②图像中T2______T1(填“高于”、“低于”、“等于”或“无法确定”),理由是____________。
③在绝热容器中进行该反应时,压缩容器体积,平衡常数__________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如图所示,下列说法中不正确的是

A.上述反应为氧化还原反应
B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶使反应充分
D.脱氢维生素C的分子式为C6H6O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
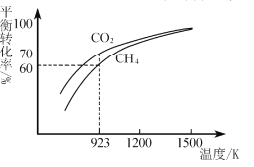
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
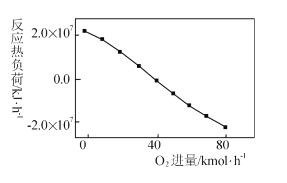
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.澄清透明的溶液中:Na+、Cu2+、NO3-、Cl-
B.中性溶液中:Fe3+、NH4+、Br-、HCO3-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、F-
的溶液中:Na+、Ca2+、ClO-、F-
D.1 mol/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO310H2O的质量为_______ g(保留2位小数)。
(2)CoCl2xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com