
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如图所示,下列说法中不正确的是

A.上述反应为氧化还原反应
B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶使反应充分
D.脱氢维生素C的分子式为C6H6O6
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
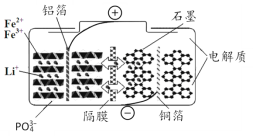
A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 |
时间/s | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/ mol·L-1 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01 mol/L,则此时反应处于____状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10 mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
② 清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)
③ 滴定过程中发现一段时间后反应速率明显加快,除去温度的影响,你认为最有可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用 30%的 FeCl3 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)在加入①物质的过程中通常不断搅拌,搅拌的目的是_____。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的 FeCl3 溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式:①________,④____。
(3)要证明某溶液中不含 Fe3+而可能含有 Fe2+,进行如下实验操作时的最佳顺序为__________。
①加入足量氯水 ②加入足量KMnO4 溶液 ③加入少量KSCN 溶液
A.①③ B.③② C.③① D.①②③
(4)写出向②⑤的混合液中通入⑥的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol/L的盐酸分别滴定20.00mL浓度均为0.10mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。

下列说法不正确的是
A. Ⅱ表示的是滴定氨水的曲线,当V(HC1)=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-)
C. 滴定氢氧化钠溶液,V(HCl) >20 mL 时一定有: c(Cl-) >c(Na+) >c(H+) >c(OH-)
D. 当滴定氨水消耗V(HC1)=10 mL 时,有: 2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物A、B、C、D、E、G间的转化关系如下图所示(以下变化中,某些反应条件及产物未标明)。B是天然有机高分子化合物,C、D可发生银镜反应,在相同条件下,G蒸气密度是氦气的22倍。
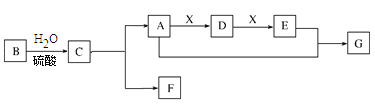
(1)B的分子式为_____、G、的结构简式为_____。
(2)E中官能团的名称_____。
(3)A的同分异构体的结构简式_____。
(4)A→D反应的化学方程式:_____、其反应类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在调节好pH和Fe2+浓度的废水中加H2O2,能氧化降解污染物。现用该方法降解污染物p-CP,控制H2O2、Fe2+和p-CP的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得p-CP的浓度随时间变化的关系如下图。
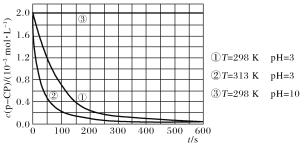
下列结论或推断不正确的是( )
A.实验①、②表明适当升高温度,降解反应速率增大
B.根据推断,在原来条件下适当升高温度和调高pH,p-CP的分解速率可能保持不变
C.313 K、pH=3时,在0~100 s内,p-CP的分解平均速率约为1.8×10-2mol·L-1·s-1
D.室温下调节溶液pH=10,可使催化剂失去活性, p-CP几乎不分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com