
【题目】某原电池装置如图所示,盐桥中装有琼脂与饱和K2SO4溶液,已知,氧化性:Cr2O72->Fe3+,下列叙述中不正确的是( )
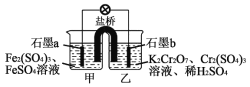
A.a电极为负极,b电极为正极
B.外电路中电子移动的方向:a极→导线→b极
C.电池工作时,盐桥中的K+移向甲烧杯
D.乙烧杯中发生的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.澄清透明的溶液中:Na+、Cu2+、NO3-、Cl-
B.中性溶液中:Fe3+、NH4+、Br-、HCO3-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、F-
的溶液中:Na+、Ca2+、ClO-、F-
D.1 mol/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO310H2O的质量为_______ g(保留2位小数)。
(2)CoCl2xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁酸-3-苯丙酯( )是一种香料,下图是这种香料的一种合成路线:
)是一种香料,下图是这种香料的一种合成路线:

已知以下信息:
①有机物E的摩尔质量为88 g·mol-1,其核磁共振氢谱表明含有3种不同环境的氢原子。
②有机物F是苯甲醇的同系物。
③R—CH==CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)异丁酸-3-苯丙酯的分子式为________________。
(2)A分子中的官能团名称为________________。
(3)C的结构简式为________________。
(4)一定条件下,1 mol D与2 mol H2能够完全反应生成F,D能够发生银镜反应,因此D生成F的反应类型为________________。
(5)E、F反应生成异丁酸-3-苯丙酯的化学方程式为________________________。
(6)已知有机化合物甲符合下列条件:
①与F是同分异构体;②苯环上有3个支链;③核磁共振氢谱显示其含有5种不同环境的氢原子,且不同环境的氢原子个数比为6∶2∶2∶1∶1;④与FeCl3溶液不能发生显色反应。
写出符合上述条件的有机物甲的结构简式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝混合物进行如下实验:
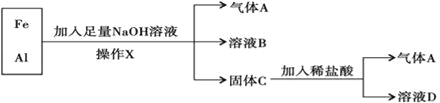
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C是一种常见塑料,通常具有一定的毒性,不能用于包装熟食;D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
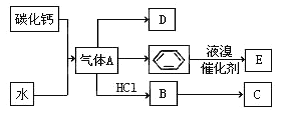
(1)写出A的电子式____;D的空间构型为平面结构,键角为____;
(2)写出碳化钙与水反应制取A的化学方程式___;苯和液溴反应生成E的化学方程式___,其反应类型为____.
(3)B→C的化学方程式___,其反应类型为___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,用还原铜粉和氯气来制备氯化铜。已知:氯化铜容易潮解。氯化亚铜微溶于水,不溶于稀盐酸和酒精。
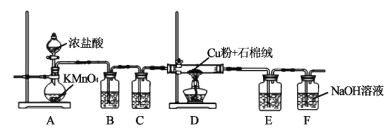
(1)装置A中发生反应的化学方程式为___。
(2)B装置的作用是___;C装置中的试剂是___;E装置的作用是___;F装置中可能发生的化学反应的离子方程式为___。
(3)当Cl2排尽空气后,加热D。装置D中的现象是___。
(4)另取CuCl2固体用于制备CuCl。将CuCl2固体溶解在适量蒸馏水中,并加入少量稀盐酸,然后向溶液中通入SO2气体并加热可得到CuCl白色沉淀,过滤、洗涤、干燥,即得CuCl晶体。
①制备CuCl反应的离子方程式为___;
②洗涤时,先用稀盐酸洗涤数次,后用酒精漂洗,用酒精漂洗的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中, xA(g)+yB(g)![]() zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
A.平衡向正反应方向移动 B.x+y<z
C.B的转化率升高 D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫等危害。在2L恒容密闭容器中一定条件下发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g);起始 CO 物质的量为 10 mol,10 min 达平衡,CO 物质的量变为 8 mol,此条件下该反应的平衡常数 K = 0.1。下列说法不正确的是
COS(g)+H2(g);起始 CO 物质的量为 10 mol,10 min 达平衡,CO 物质的量变为 8 mol,此条件下该反应的平衡常数 K = 0.1。下列说法不正确的是
A.升高温度,H2S 浓度增加,表明该反应是放热反应
B.10 min 内平均速率:v(COS)=0.1 mol·L-1·min-1
C.反应前 H2S 物质的量为 5 mol
D.CO 的平衡转化率为 20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com