
【题目】配制一定体积一定浓度的NaOH溶液时,下列操作导致结果偏高的是
A.称量NaOH固体时动作缓慢 B.定容时俯视刻度线
C.定容后振荡发现液面低于刻度线 D.未洗涤烧杯和玻璃棒
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列与化学相关的说法正确的是
A. 水泥、水玻璃、水晶均属于硅酸盐产品
B. 医用酒精和葡萄糖注射液可用丁达尔效应区分
C. 氯水和食盐水消毒杀菌的原理相同
D. 铵态氮肥和草木灰混合使用会降低肥效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色
B.自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性
C.Cl2、Cl-均有毒
D.Cl2、HClO、H2O2都具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下.用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对 数值lgc(S2-)与lgc(M2+)关系如下图所示,下列说法正确的是
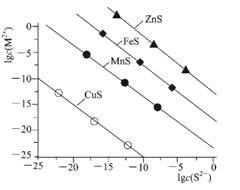
A.室温时.向ZnS悬浊液中加人ZnSO4固体,.Ksp(ZnS)将随之减小
B.Na2S溶液中:c(OH-)<c(H+)+c(HS-)+c(H2S)
C.为除去MnCl2溶液中混有的少量 CuCl2,可加入适量Na2S固体,充分搅拌后过滤
D.向100 mL浓度均为1×10-5mol/L的Fe2+、Zn2+混合溶液中逐滴加入1×10-4mol/LNa2S溶液,Fe2+先沉淀,证明Ksp(FeS)<Ksp(ZnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于物质分类正确的组合是
组合分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaF2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池开始应用于新能源汽车,但电池使用后电极材料对环境还是有一定的危害, 某型号镍电池的电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。研究小组设计如下工艺流程,对该电池的电极材料进行资源回收:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实验温度时的溶解度:NiC2O4> NiC2O4H2O> NiC2O42H2O
③某温度下:Ksp[Ni(OH)2] = 5.0×10-16、Ksp[NiC2O4]=4.0×10-10、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=3.0×10-34
回答下列问题:
(1)用NiO调节溶液的pH,首先析出的沉淀是__________,控制这两种沉淀能够依次析出可利用________(仪器名称)。
(2)过滤①得到的沉淀为___________,洗涤Ni(OH)3沉淀的方法是__________。
(3)写出加入NaOH溶液发生反应的离子方程式_________,该反应的化学平衡常数K=_________。
(4)电解过程中阴极反应式为___________,沉淀Ⅲ可被电解所得产物之一氧化,写出“氧化”的离子方程式____________。
(5)铁镍蓄电池的电池总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,该电池的电解液为___________(填“酸性”或“碱性”)溶液,充电时正极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是进行化学研究的重要环节,下列有关化学实验的说法正确的是( )
A. 向滴有KSCN的FeCl3溶液中加入NaOH溶液以研究反应物浓度对化学平衡的影响
B. 用酒精萃取碘水中的碘,水从分液漏斗下口放出,碘的酒精溶液从分液漏斗上口倒出
C. 将高锰酸钾溶液装入碱式滴定管中进行滴定实验,以测定某FeSO4样品的纯度
D. 为制备硅酸胶体,以酚酞为指示剂,将浓盐酸滴入饱和Na2SiO3溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com