
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
【答案】D
【解析】
图B中的两电极均为石墨,即B装置为电解装置,A装置为原电池装置。当 K 闭合时,在交换膜处 SO42一从右向左移动,即可知A电极为原电池的负极,B为原电池的正极,所以y电极为电解池装置的阳极,x电极为电解池装置的阴极。
A、A处的电极反应式为:A-2e-=A2+;溶液中A2+增大,A错误;
B、B电极是正极得电子的一极,B错误;
C、在y中,电极反应式为:2Cl-—2e-=Cl2↑,C错误;
D、在x极,电极反应式为:2H++2e-=H2↑,破坏了附近的水的电离平衡,在x周围,c(OH-)增大,生成氢氧化铝沉淀,随c(OH-)溶液的增大,氢氧化铝逐渐溶解,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是 ( )
H++OH- △H>0,下列叙述正确的是 ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O=2Cr2O42-(黄色)+2H+。请回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是___。
(2)为探究(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,按如图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是___。
②C的作用是___。
③反应结束后,依然要通一段时间的氮气的原因是___。
④加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量的变化分别为200g、1.44g,写出重铬酸铵加热分解反应的化学方程式:___。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为 2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H滴定时,1mo1(CH2)N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL2.000 mo1L-1的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200mo1L-1NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为20.00mL。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去的NaOH标准溶液的体积___(填“偏大”“偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为![]() ,下列说法正确的是( )
,下列说法正确的是( )
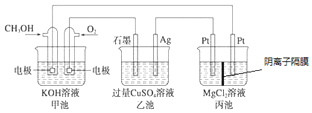
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入![]() 的电极反应式为
的电极反应式为![]()
C.反应一段时间后,向乙池中加入一定量![]() 固体能使溶液恢复原浓度
固体能使溶液恢复原浓度
D.甲池中消耗![]() 标准状况下
标准状况下![]() ,此时丙池中理论上最多产生
,此时丙池中理论上最多产生![]() g固体
g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
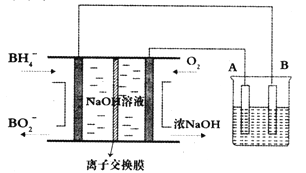
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O
C. 电解池中的电解质溶液可以选择CuSO4溶液
D. 每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了如下图装置,反应完毕,电解质溶液的pH保持不变。下列说法正确的是
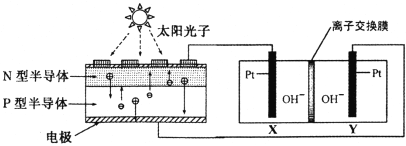
A. 图中N型半导体为正极,P型半导体为负极
B. Y 电极的反应:4OH--4e-=2H2O +O2↑
C. 图中离子交换膜为阳离子交换膜
D. 该装置实现了“太阳能→化学能→电能”的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家设计了一种微生物燃料电池(MFC)。它是一种现代化氨氮去除技术。下图为MFC碳氮联合去除的氮转化系统原理示意图。当该装置工作时,下列有关叙述正确的是

A.温度越高,该装置的转化效率越高
B.电极A上的电势比电极B上的高
C.该系统的总反应:4CH3COONH4+11O2=8CO2 +2N2+14H2O
D.MFC电池的阳极反应式为2NO3-+10e-+12H+=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应N2 ( g ) +3H2 ( g ) = 2NH3 ( g ) ,反应过程的能量变化如图所示。已知N2 ( g ) 与 H2( g )反应生成 17 gNH3(g),放出46. 1kJ的热量。请回答下列问题:
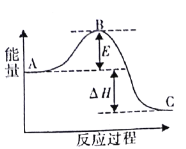
(1)该反应通常用铁作催化剂,加催化剂会使图中E_______________(填“变大”或“变小”) ,E 的大小对该反应的反应热有无影响?___________,理由是__________。
(2)图中△H=________kJ·mol -1。
(3)起始充入2mol·L-1N2和5.5mol·L-1H2,经过50min,NH3的浓度为1mol·L-1,则v(N2)=______mol·L-1·min-1,c(H2)=_____mol·L-1
(4)已知NH3(g)=NH3(l) △H=-QkJ·mol-1,则N2 ( g ) +3H2 ( g ) = 2NH3 ( l )的△H=_______kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com