
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |




 ;
;
 ;
;


科目:高中化学 来源: 题型:
| ① | ⑩ | ② | ③ | ||||||||||||||
| ④ | ⑤ | ⑦ | ⑧ | ⑨ | |||||||||||||
| ⑥ | |||||||||||||||||




查看答案和解析>>
科目:高中化学 来源: 题型:


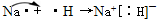
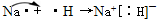




查看答案和解析>>
科目:高中化学 来源: 题型:
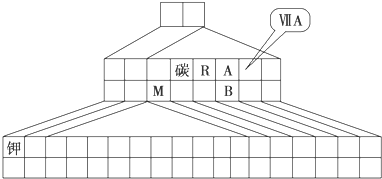
2- 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
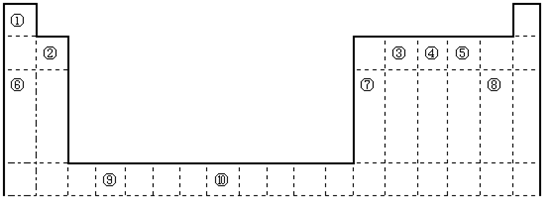
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com