
| 10.8g |
| 108g/mol |
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1:10 | B、1:9 |
| C、10:1 | D、9:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中N-Cl键键长与CCl4分子中C-Cl键键长相等 |
B、在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3?H2O分子,则NH3?H2O的结构式为 |
| C、NCl3分子是非极性分子 |
| D、NBr3比NCl3易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶液中滴入硝酸银溶液 |
| B、铁片置于硫酸铜溶液中 |
| C、铁在氧气中燃烧 |
| D、二氧化碳通入澄清石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P既是氯化剂又是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、CuSO4发生了还原反应 |
| D、当生成lmol Cu3P时,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b>c>d |
| B、b>a>d>c |
| C、c>d>b>a |
| D、d>c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、Na2CO3、氢氧化钡 |
| B、盐酸、烧碱、CuSO4 |
| C、碳酸、乙醇、Na2CO3 |
| D、硝酸、熟石灰、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
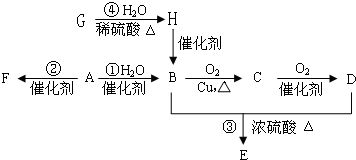
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com