
| A、1:10 | B、1:9 |
| C、10:1 | D、9:1 |
| 0.1x |
| x+y |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
| 实验操作 | 预期实验现象和结论 |
| 若 若 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经气化和液化两个物理过程,可变为清洁能源 |
| B、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| C、明矾水解得到Al(OH)3胶体,可用作自来水厂的消毒杀菌剂 |
| D、静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | R | ||||||||||||||||
| C | D | E | F | ||||||||||||||
| B | H | I | J | K | L | ||||||||||||
| G | M | N | T | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有AgI沉淀生成 |
| B、最先生成AgI沉淀,但是AgCl沉淀最多 |
| C、最先生成AgCl且最多 |
| D、AgCl、AgBr、AgI沉淀等物质量生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的铝分别投入过量的稀盐酸和NaOH溶液中,反应生成的气体在相同条件下体积相等 |
| B、金属单质与水反应都生成对应的碱和氢气 |
| C、活泼的金属或较活泼的金属都能与酸反应,但不能与碱反应 |
| D、由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表中钠后面的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目减少 | ||
B、溶液中
| ||
| C、醋酸的电离程度增大,c(OH-)亦增大 | ||
| D、再加入10 mL c(OH-)=10-3 mol?L-1的NaOH溶液,醋酸与NaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
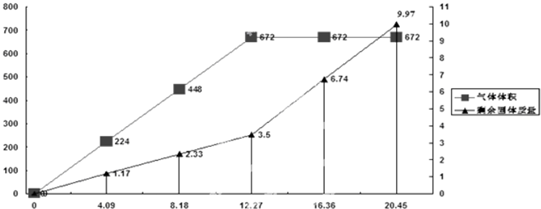
A、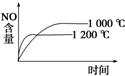 |
B、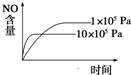 |
C、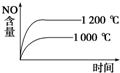 |
D、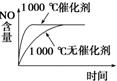 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com