
【题目】NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。某兴趣小组同学用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应的铝灰及硫酸铵等为原料制备铵明矾的实验,步骤如下:

(1)下列有关说法中正确的是__(填字母)。
A.“滤液1”中含有K+、Mg2+、Cl-
B.“滤渣1”和“滤渣2”中含有相同的物质
C.“滤渣2”中含有氢氧化铁,氢氧化镁等固体
D.将“滤液3”蒸干并灼烧,可得纯碱
(2)用NaOH溶解“滤渣1”时,可以采用__方式提高浸出率。
(3)用NaOH溶解“滤渣1”时,可能发生的反应的化学方程式为①__、②_____。
(4)向“滤液2”中通入足量的CO2,写出相应的离子反应方程式:__。
【答案】BD 加热、适当增大NaOH浓度、搅拌 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al2O3+2NaOH=2NaAlO2+H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾,铝灰用“水洗”的目的是除去KCl等可溶性杂质,滤渣1为Al、Al2O3、Fe、MgO、Fe2O3等,滤液1为氯化钾溶液,滤渣1用碱溶解,Al、Al2O3反应得到NaAlO2、H2,Fe、MgO、Fe2O3等不与碱反应,过滤得到滤渣2为Fe、MgO、Fe2O3,滤液2中含有NaAlO2及剩余的碱,向滤液2中通入二氧化碳气体和氢氧化钠反应生成碳酸氢钠、氢氧化铝沉淀,然后过滤,则滤渣3为氢氧化铝,滤渣氢氧化铝溶于硫酸溶液,将硫酸铝溶液转移至蒸发皿,配制饱和硫酸铵溶液加入蒸发皿中,蒸发至表面出现晶膜,降温结晶,抽滤得到铵明矾,以此解答该题。
:(1)A.“滤液1”中是氯化钾溶液,含有K+、Cl-不含镁离子,故A错误;
B.分析可知“滤渣1”和“滤渣2”中含有相同的物质Fe、Mg、Fe2O3,故B正确;
C.滤渣2为Fe、MgO、Fe2O3,,故C错误;
D.将“滤液3”含有碳酸氢钠,蒸干并灼烧,可得纯碱,故D正确。故答案为:BD;
(2)用NaOH溶解“滤渣1”时,可以采用加热、提高NaOH浓度、搅拌等,故答案为:加热、适当提高NaOH浓度、搅拌等;
(3)滤渣1中与氢氧化钠反应的物质为Al和Al2O3,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al2O3+2NaOH=2NaAlO2+H2O;
(4)向“滤液2”中通入足量的CO2,主要是和偏铝酸根发生反应,方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;


科目:高中化学 来源: 题型:
【题目】将NaAlO2、Ba(OH)2、NaOH配成100.0 mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的物质的量n(CO2)的关系,如图所示,下列说法中正确的是

A. P点的值为0.6
B. 混合溶液中c(NaOH)+c(NaAlO2)=4.0 mol/L
C. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
D. cd段表示Al(OH)3沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
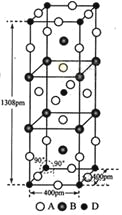
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中 F 可以作内燃机的抗冻剂,J 分子中无饱和碳原子。已知:R1—CH==CH—R2→R1—CHO+R2—CHO
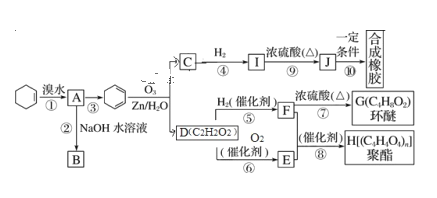
(1)A的结构简式为_____③的反应试剂及条件是______
(2)有机物B和 I的关系为_____(填字母)。
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(3)H的名称_________
(4)写出下列反应的化学方程式并注明反应类型:
反应⑨_________;________
(5)写出两种C的属于酯类的链状同分异构体的结构简式:_________;________
(6)参照题给信息,试写出以 2-丁烯为原料制取乙酸乙酯的合成路线流程图(无机原料任选)
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
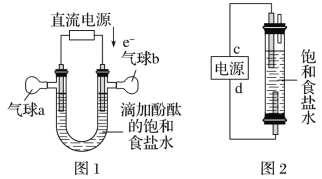
(1)图1中,电解一段时间后,气球b中的气体是___(填化学式)。
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分NaClO,则c为电源的__极;该发生器中反应的总离子方程式为__。
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
①阳极产生ClO2的电极反应式:__。
②当阴极产生标准状况下112mL气体时,通过阳离子交换膜离子的物质的量为___。
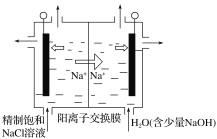
(4)装置2中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中c(Cu2+)__(填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是NH4NO3的琼脂溶液,则盐桥中的__离子(填“NH4+”或“NO3-”)向氯化铁溶液迁移。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:

(1)废铁渣进行“粉碎”的目的是_____。
(2)①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_____。
②酸浸时,通入O2的目的是_____。
(3)滤渣的主要成分为____(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-![]() 被还原为Cr3+),该滴定反应的离子方程式为_____。
被还原为Cr3+),该滴定反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
|
|
A.证明非金属性氯>碳>硅(A、B、D中的试剂分别为盐酸、石灰石和硅酸钠溶液) | B.石油分馏 |
|
|
C.用KMnO4 与浓盐酸反应制取适量氯气的 简易装置 | D.实验室制乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
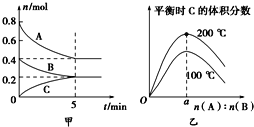
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4 LCCl4含有的分子数为NA
B.标准状况下,aL氧气和氮气的混合气体含有的分子数约为![]()
C.46g NO2和N2O4的混合气体中含有的原子数为6NA
D.56gFe与足量的盐酸反应,转移的电子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com