
ЁОЬтФПЁП[ЛЏбЇЁЊбЁао3ЃКЮяжЪНсЙЙгыаджЪ]
ЧАЫФжмЦкдзгађЪ§вРДЮдіДѓЕФдЊЫиAЃЌBЃЌCЃЌDжаЃЌAКЭBЕФМлЕчзгВужаЮДГЩЖдЕчзгОљжЛга1ИіЃЌЦНЧвA-КЭB+ЕФЕчзгЯрВюЮЊ8ЃЛгыBЮЛгкЭЌвЛжмЦкЕФCКЭDЃЌЫќУЧМлЕчзгВужаЕФЮДГЩЖдЕчзгЪ§ЗжБ№ЮЊ4КЭ2ЃЌЧвдзгађЪ§ЯрВюЮЊ2ЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉD2+ЕФМлВуЕчзгХХВМЭМЮЊ_______ЁЃ
ЃЈ2ЃЉЫФжждЊЫижаЕквЛЕчРызюаЁЕФЪЧ________ЃЌЕчИКадзюДѓЕФЪЧ________ЁЃЃЈЬюдЊЫиЗћКХЃЉ
ЃЈ3ЃЉAЁЂBКЭDШ§жждЊЫид№ГЩЕФвЛИіЛЏКЯЮяЕФОЇАћШчЭМЫљЪОЁЃ
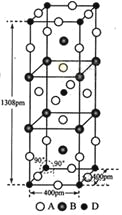
ЂйИУЛЏКЯЮяЕФЛЏбЇЪНЮЊ_________________ЃЛDЕФХфЮЛЪ§ЮЊ___________ЃЛ
ЂкСаЪНМЦЫуИУОЇЬхЕФУмЖШ_______gЁЄcm-3ЁЃ
ЃЈ4ЃЉA-ЁЂB+КЭC3+Ш§жжРызгзщГЩЕФЛЏКЯЮяB3CA6ЃЌЦфжаЛЏбЇМќЕФРраЭга_____________ЃЛИУЛЏКЯЮяжаДцдквЛИіИДдгРызгЃЌИУРызгЕФЛЏбЇЪНЮЊ_______________ЃЌХфЮЛЬхЪЧ____________ЁЃ
ЁОД№АИЁП![]() K F K2NiF4 6
K F K2NiF4 6 ![]() =3.4 РызгМќЁЂХфЮЛМќ [FeF6]3- F-
=3.4 РызгМќЁЂХфЮЛМќ [FeF6]3- F-
ЁОНтЮіЁП
ЃЈ1ЃЉБОЬтПМВщЕчзгХХВМЭМЕФЪщаДЃЌAКЭBЕФМлЕчзгВужаЮДГЩЖдЕчзгОљжЛга1ИіЕчзгЃЌAКЭBЮЛгкЕкIAзхЃЌЛђЕкIIIAзхдЊЫиЛђVIIAзхдЊЫиЃЌAЃКЭBЃЋЕФЕчзгЪ§ЯрВюЮЊ8ЃЌЭЦГіAЮЊFЃЌBЮЊKЃЌгыBЮЛгкЭЌвЛжмЦкЕФCКЭDЃЌЫќУЧМлЕчзгВужаЕФЮДГЩЖдЕчзгЪ§ЗжБ№ЮЊ4КЭ2ЃЌЧвдзгађЪ§ЯрВюЮЊ2ЃЌдђCЮЊFeЃЌDЮЊNiЃЌD2ЃЋЮЊNi2ЃЋЃЌЦфМлВуЕчзгХХВМЭМЮЊ![]() ЃЛ
ЃЛ
ЃЈ2ЃЉЕквЛЕчРыФмдНаЁЃЌЫЕУїдНШнвзЪЇШЅЕчзгЃЌМДН№ЪєадЧПЃЌЕквЛЕчРыФмзюаЁЕФЪЧKЃЌЕчИКадзюДѓЃЌЫЕУїЗЧН№ЪєадзюЧПЃЌМДFЕФЕчИКадзюЧПЃЛ
ЃЈ3ЃЉЂйИљОнОЇАћЕФНсЙЙЃЌFЮЛгкРтЩЯЁЂОЇАћФкВПЁЂКЭУцЩЯЃЌвђДЫFЕФИіЪ§ЮЊ16ЁС1/4ЃЋ4ЁС1/2ЃЋ2=8ЃЌKЮЛгкРтЩЯКЭФкВПЃЌИіЪ§ЮЊ8ЁС1/4ЃЋ2=4ЃЌNiЮЛгкЖЅЕуКЭФкВПЃЌИіЪ§ЮЊ8ЁС1/8ЃЋ1=2ЃЌвђДЫЛЏбЇЪНЮЊK2NiF4ЃЛNiЕФХфЮЛЪ§ЮЊ6ЃЛ
ЂкОЇАћЕФжЪСПЮЊ1ЁС(39ЁС4ЃЋ59ЁС2ЃЋ19ЁС8)/NA gЃЌОЇАћЕФЬхЛ§ЮЊ400ЁС400ЁС1308ЁС10-30cm3ЃЌвђДЫОЇАћЕФУмЖШЮЊ![]() =3.4g/cm3ЃЛ
=3.4g/cm3ЃЛ
ЃЈ4ЃЉзщГЩЕФЛЏбЇЪНЮЊK3FeF6ЃЌДЫЛЏКЯЮяЪєгкХфКЯЮяЃЌKЃЋКЭFeF63ЃжЎМфЪЧРызгМќЃЌFeКЭFжЎМфЮЊХфЮЛМќЃЛИУРызгЪЧ[FeF6]3ЃЃЌХфЬхЮЊF-ЁЃ


 ШЪАЎгЂгяЭЌВНСЗЯАВсЯЕСаД№АИ
ШЪАЎгЂгяЭЌВНСЗЯАВсЯЕСаД№АИ бЇЯАЪЕМљдАЕиЯЕСаД№АИ
бЇЯАЪЕМљдАЕиЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЫФжжВЛЭЌЖбЛ§ЗНЪНЕФН№ЪєОЇЬхЕФОЇАћШчЭМЫљЪОЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A. ЂйЮЊМђЕЅСЂЗНЖбЛ§ЃЌЂкЮЊУОаЭЃЌЂлЮЊМиаЭЃЌЂмЮЊЭаЭ
B. УПИіОЇАћКЌгаЕФдзгЪ§ЗжБ№ЮЊЃКЂй1ИіЃЌЂк2ИіЃЌЂл2ИіЃЌЂм4Иі
C. ОЇАћжадзгЕФХфЮЛЪ§ЗжБ№ЮЊЃКЂй6ЃЌЂк8ЃЌЂл8ЃЌЂм12
D. ПеМфРћгУТЪЕФДѓаЁЙиЯЕЮЊЃКЂйЃМЂкЃМЂлЃМЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯжЦШЁClO2ЕФЛЏбЇЗДгІ:2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4,ЯТСаЫЕЗЈжае§ШЗЕФЪЧ
2ClO2+2NaHSO4,ЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A. NaClO3дкЗДгІжаЪЇШЅЕчзг
B. SO2дкЗДгІжаБЛбѕЛЏ
C. H2SO4дкЗДгІжазїбѕЛЏМС
D. 1 molбѕЛЏМСдкЗДгІжаЕУЕН2 molЕчзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊСЫМЭФюдЊЫижмЦкБэЕЎЩњ150жмФъЃЌСЊКЯЙњНЋ2019ФъЖЈЮЊЁАЙњМЪЛЏбЇдЊЫижмЦкБэФъЁБЁЃЛиД№ЯТСаЮЪЬтЃК
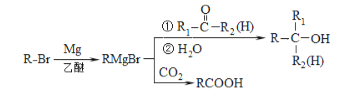
(1)AgгыCuдкЭЌвЛзхЃЌдђAgдкжмЦкБэжа_____ЃЈЬюЁАsЁБЁЂЁАpЁБЁЂЁАdЁБЛђЁАdsЁБЃЉЧјЁЃ[Ag(NH3)2]+жаAg+ПеЕФ5sЙьЕРКЭ5pЙьЕРвдspдгЛЏГЩМќЃЌдђИУХфРызгЕФПеМфЙЙаЭЪЧ_____ЁЃ
(2)БэжаЪЧFeКЭCuЕФВПЗжЕчРыФмЪ§ОнЃКЧыНтЪЭI2(Cu)ДѓгкI2(Fe)ЕФжївЊдвђЃК______ЁЃ
дЊЫи | Fe | Cu |
ЕквЛЕчРыФмI1/kJЁЄmolЃ1 | 759 | 746 |
ЕкЖўЕчРыФмI2/kJЁЄmolЃ1 | 1561 | 1958 |
(3)бЧЬњЧшЛЏМиЪЧЪГбЮжаГЃгУЕФПЙНсМСЃЌЦфЛЏбЇЪНЮЊK4[Fe(CN)6]ЁЃ
ЂйCN-ЕФЕчзгЪНЪЧ______ЃЛ1molИУХфРызгжаКЌІвМќЪ§ФПЮЊ______ЁЃ
ЂкИУХфКЯЮяжаДцдкЕФзїгУСІРраЭга______ЃЈЬюзжФИЃЉЁЃ
AЃЎН№ЪєМќ BЃЎРызгМќ CЃЎЙВМлМќ DЃЎХфЮЛМќ EЃЎЧтМќ FЃЎЗЖЕТЛЊСІ
(4)MnOЕФШлЕу(1660Ёц)БШMnSЕФШлЕу(1610Ёц)ИпЃЌЦфжївЊдвђЪЧ________ЁЃ
(5)ЕкШ§ДњЬЋбєФмЕчГиРћгУгаЛњН№ЪєТБЛЏЮяЕтЛЏЧІМзАЗ(CH3NH3PbI3)АыЕМЬхзїЮЊЮќЙтВФСЯЃЌCH3NH3PbI3ОпгаИЦюбПѓ(AMX3)ЕФСЂЗННсЙЙЃЌЦфОЇАћШчЭМЫљЪОЁЃ
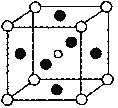
ЂйAMX3ОЇАћжагыН№ЪєбєРызг(M)ОрРызюНќЕФТБЫивѕРызг(X)аЮГЩе§АЫУцЬхНсЙЙЃЌдђMДІгк_______ЮЛжУЃЌXДІгк______ЮЛжУЃЈЯобЁЁАЬхаФЁБЁЂЁАЖЅЕуЁБЁЂЁАУцаФЁБЛђЁАРтаФЁБНјааЬюПеЃЉЁЃ
ЂлCH3NH3PbI3ОЇЬхЕФОЇАћВЮЪ§ЮЊa nmЃЌЦфОЇЬхУмЖШЮЊdgЁЄcm-3ЃЌдђАЂЗќМгЕТТоГЃЪ§ЕФжЕNAЕФМЦЫуБэДяЪНЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяIЪЧвЛжжПЙФдШБбЊвЉЮяЃЌКЯГЩТЗЯпШчЯТЃК
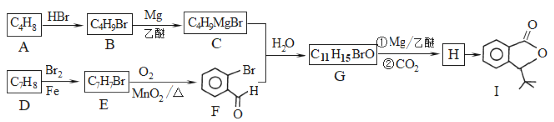
вбжЊЃК
ЛиД№ЯТСаЮЪЬтЃК
(1)АДееЯЕЭГУќУћЗЈЃЌAЕФУћГЦЪЧ_____ЃЛаДГіAЗЂЩњМгОлЗДгІЕФЛЏбЇЗНГЬЪНЃК__________ЁЃ
(2)ЗДгІHЁњIЕФЛЏбЇЗНГЬЪНЮЊ________ЃЛЗДгІEЁњFЕФЗДгІРраЭЪЧ______ЁЃ
(3)аДГіЗћКЯЯТСаЬѕМўЕФGЕФЫљгаЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЃК________
ЂйгіFeCl3ШмвКЗЂЩњЯдЩЋЗДгІ ЂкКЫДХЙВеёЧтЦзга4зщЗх
(4)ІС,ІС-ЖўМзЛљмаДМ(![]() )ЪЧКЯГЩвНвЉЁЂХЉвЉЕФжаМфЬхЃЌвдБНКЭ2-ТШБћЭщЮЊЦ№ЪМдСЯжЦБИІС,ІС-ЖўМзЛљмаДМЕФКЯГЩТЗЯпШчЯТЃК
)ЪЧКЯГЩвНвЉЁЂХЉвЉЕФжаМфЬхЃЌвдБНКЭ2-ТШБћЭщЮЊЦ№ЪМдСЯжЦБИІС,ІС-ЖўМзЛљмаДМЕФКЯГЩТЗЯпШчЯТЃК

ИУКЯГЩТЗЯпжаXЕФНсЙЙМђЪНЮЊ____ЃЌYЕФНсЙЙМђЪНЮЊ________ЃЛЪдМСгыЬѕМў2ЮЊ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяI(C11H12O3)ЪЧжЦБИвКОЇВФСЯЕФжаМфЬхжЎвЛЃЌЦфЗжзгжаКЌгаШЉЛљКЭѕЅЛљЁЃIПЩвдгУEКЭHдквЛЖЈЬѕМўЯТКЯГЩЃК

вбжЊвдЯТаХЯЂЃКЂй AЕФКЫДХЙВеёЧтЦзБэУїЦфжЛгавЛжжЛЏбЇЛЗОГЕФЧтЃЛ
ЂкRЁЊCHЃНCH2![]() RЁЊCH2CH2OHЃЛЂлЛЏКЯЮяFБНЛЗЩЯЕФвЛТШДњЮяжЛгаСНжжЃЛЂмЭЈГЃдкЭЌвЛИіЬМдзгЩЯСЌгаСНИієЧЛљВЛЮШЖЈЃЌвзЭбЫЎаЮГЩєЪЛљЁЃ
RЁЊCH2CH2OHЃЛЂлЛЏКЯЮяFБНЛЗЩЯЕФвЛТШДњЮяжЛгаСНжжЃЛЂмЭЈГЃдкЭЌвЛИіЬМдзгЩЯСЌгаСНИієЧЛљВЛЮШЖЈЃЌвзЭбЫЎаЮГЩєЪЛљЁЃ
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉAЕФЛЏбЇУћГЦЮЊ______________ЁЃ
ЃЈ2ЃЉDЕФНсЙЙМђЪНЮЊ_____________ЁЃ
ЃЈ3ЃЉEЕФЗжзгЪНЮЊ_________________ЁЃ
ЃЈ4ЃЉFЩњГЩGЕФЛЏбЇЗНГЬЪНЮЊ________________________ЃЌИУЗДгІРраЭЮЊ__________ЁЃ
ЃЈ5ЃЉIЕФНсЙЙЭВЪНЮЊ____________ЁЃ
ЃЈ6ЃЉIЕФЭЌЯЕЮяJБШIЯрЖдЗжзгжЪСПаЁ14ЃЌJЕФЭЌЗжвьЙЙЬхжаФмЭЌЪБТњзуШчЯТЬѕМўЃК
ЂйБНЛЗЩЯжЛгаСНИіШЁДњЛљЃЌЂкМШФмЗЂЩњвјОЕЗДгІЃЌгжФмгыБЅКЭNaHCO3ШмвКЗДгІЗХГіCO2ЃЌЗћКЯвдЩЯЬѕМўЕФЭЌЗжвьЙЙЬхЙВга___________жжЁЃ
JЕФвЛжжЭЌЗжвьЙЙЬхЗЂЩњвјОЕЗДгІВЂЫсЛЏКѓКЫДХЙВеёЧтЦзЮЊШ§зщЗхЃЌЧвЗхУцЛ§БШЮЊ2ЃК2ЃК1ЃЌаДГіJЕФетжжЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаНтЪЭЙ§ГЬЛђЪТЪЕЕФЗНГЬЪНВЛе§ШЗЕФЪЧ( )
A.ТШЦјгУгкздРДЫЎЯћЖОЃКCl2+H2OЃНHCl+HClO
B.ЬњПЩвдКЭЯЁСђЫсЗДгІЃК2Fe+3H2SO4ЃНFe2(SO4)3 +3H2Ёќ
C.ПЬжЦгЁЫЂЕчТЗАхЪБГЃгУТШЛЏЬњШмвКзїЮЊЁАИЏЪДвКЁБПЬЪДЭАх 2Fe3++CuЃН2Fe2++ Cu2+.
D.КьШШЕФЬњЫПгыЫЎНгДЅЃЌБэУцаЮГЩРЖКкЩЋ(ЛђКкЩЋ)БЃЛЄВуЃК3Fe + 4H2O(g)![]() Fe3O4 + 4H2
Fe3O4 + 4H2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNH4Al(SO4)2ЁЄ12H2O(яЇУїЗЏ)ПЩгУзїХнФУ№Л№ЦїЕФФкСєМСЁЂЪЏгЭЭбЩЋМСЕШЁЃФГаЫШЄаЁзщЭЌбЇгУбѕЛЏЬњЁЂТСЗлЁЂУОЬѕКЭТШЫсМиЕШЮяжЪзіТСШШЗДгІЕФТСЛвМАСђЫсяЇЕШЮЊдСЯжЦБИяЇУїЗЏЕФЪЕбщЃЌВНжшШчЯТЃК

ЃЈ1ЃЉЯТСагаЙиЫЕЗЈжае§ШЗЕФЪЧ__(ЬюзжФИ)ЁЃ
A.ЁАТЫвК1ЁБжаКЌгаKЃЋЁЂMg2ЃЋЁЂCl-
B.ЁАТЫдќ1ЁБКЭЁАТЫдќ2ЁБжаКЌгаЯрЭЌЕФЮяжЪ
C.ЁАТЫдќ2ЁБжаКЌгаЧтбѕЛЏЬњЃЌЧтбѕЛЏУОЕШЙЬЬх
D.НЋЁАТЫвК3ЁБеєИЩВЂзЦЩеЃЌПЩЕУДПМю
ЃЈ2ЃЉгУNaOHШмНтЁАТЫдќ1ЁБЪБЃЌПЩвдВЩгУ__ЗНЪНЬсИпНўГіТЪЁЃ
ЃЈ3ЃЉгУNaOHШмНтЁАТЫдќ1ЁБЪБЃЌПЩФмЗЂЩњЕФЗДгІЕФЛЏбЇЗНГЬЪНЮЊЂй__ЁЂЂк_____ЁЃ
ЃЈ4ЃЉЯђЁАТЫвК2ЁБжаЭЈШызуСПЕФCO2ЃЌаДГіЯргІЕФРызгЗДгІЗНГЬЪНЃК__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧЯѕЫсФЦЃЈNaNO2ЃЉЪЧбЧЯѕЫсИљРызггыФЦРызгзщГЩЕФЙЄвЕбЮЃЌОпгаЯЬЮЖЃЌЦфЫЎШмвКГЪМюадЃЎбЧЯѕЫсФЦгаЖОЃЌКЌгаЙЄвЕбЮЕФЪГЦЗЖдШЫЬхЮЃКІКмДѓЃЌгажТАЉадЃЎМгШШЕН320ЁцвдЩЯдђЗжНтЃЌЩњГЩбѕЦјЃЌЕЊЦјКЭбѕЛЏФЦЃЌФмгыAgNO3ШмвКЗДгІЩњГЩФбШмгкЫЎЁЂвзШмгкЫсЕФAgNO2ЃЎ
ЃЈ1ЃЉШЫЬхе§ГЃЕФбЊКьЕААзКЌгаFe2+ЃЎШєЮѓЪГNaNO2ЃЌдђЕМжТбЊКьЕААзжаЕФFe2+зЊЛЏЮЊFe3+ЖјжаЖОЃЌЗўгУЮЌЩњЫиCПЩНтЖОЃЎЯТСаа№ЪіВЛе§ШЗЕФЪЧ___________________________ЃЈЬюађКХЃЉЃЎ
AЃЎбЧЯѕЫсбЮБЛЛЙд BЃЎЮЌЩњЫиCЪЧбѕЛЏМС
CЃЎЮЌЩњЫиCНЋFe3+ЛЙдЮЊFe2+ DЃЎбЧЯѕЫсбЮЪЧбѕЛЏМС
ЃЈ2ЃЉЯТСаЗНЗЈжаЃЌВЛФмгУРДЧјЗжNaNO2КЭNaClЕФЪЧ_________________ЃЈЬюађКХЃЉЃЎ
AЃЎВтЖЈетСНжжШмвКЕФpH BЃЎгУПъзгеКШЁЙЬЬхЦЗГЂЮЖЕР
CЃЎМгЧПШШЪеМЏЦјЬхМьбщ DЃЎгУHNO3ЫсЛЏЕФAgNO3МјБ№
ЃЈ3ЃЉбЧЯѕЫсФЦЪмШШЗжНтЕФЛЏбЇЗДгІЗНГЬЪНЮЊЃК4NaNO2![]() 2N2Ёќ+3O2Ёќ+2Na2O
2N2Ёќ+3O2Ёќ+2Na2O
ЂйДгбѕЛЏЛЙдЗДгІНЧЖШЗжЮіЃЌИУЗДгІЫЕУїNaNO2Опга_____________________ЃЎЃЈЬюбѕЛЏадЁЂЛЙдадЛђепМШгабѕЛЏадгжгаЛЙдадЃЉ
ЂкИУЗДгІжаЕФЛЙдВњЮяЮЊ______________________ЃЈаДУћГЦЃЉ
ЂлШєЗДгІжазЊвЦ3molЕчзгЃЌЕУЕНNa2OЕФжЪСПЮЊ________________gЃЎ
ЃЈ4ЃЉМКжЊCl2ОпгаЧПбѕЛЏадЃЌФмНЋШмвКжаЕФNO2ЉбѕЛЏЮЊNO3ЉЭЌЪБЩњГЩбЮЫсЃЌЧыаДГіNaNO2ШмвКжаЭЈШыCl2ЕФРызгЗДгІЗНГЬЪН____________________________________________________________________________ЃЎ
ЃЈ5ЃЉФГЙЄГЇЗЯвКжаЃЌКЌ2%ЁЋ5%ЕФNaNO2ЃЌжБНгХХЗХЛсдьГЩЮлШОЃЌNH2ClФмЪЙNaNO2зЊЛЏЮЊВЛв§Ц№ЖўДЮЮлШОЕФN2ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______________________________________________________________ЃЎ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com