
【题目】如图实验装置,将液体A逐滴加入到固体B中,下列叙述正确的是

A. 若A为H2O2,B为MnO2,C中Na2S溶液变浑浊
B. 若A为浓盐酸,B为MnO2,C中KI淀粉溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中AlCl 3溶液先产生白色沉淀后 沉淀又溶解
D. 若A为浓盐酸 ,B为CaCO3,C中Na2SiO3 溶液出现白色沉淀,则非金属性C>Si
【答案】A
【解析】A.MnO2作催化剂H2O2分解生成氧气,能氧化Na2S生成S;
B.浓盐酸和MnO2不加热不反应;
C.浓氨水滴入生石灰生成氨气,氨气和铝离子反应生成氢氧化铝,但氢氧化铝不溶于氨水;
D.浓盐酸和CaCO3反应生成CO2,CO2与Na2SiO3溶液反应生成硅酸白色沉淀,但由于浓盐酸易挥发,挥发出的HCl,也可与Na2SiO3溶液反应生成硅酸白色沉淀。
A.若A为H2O2,B为MnO2,生成的气体为氧气,能氧化Na2S生成S,则C中溶液变浑浊,故A正确;
B.若A为浓盐酸,B为MnO2,但无加热装置,无氯气生成,故B错误;
C.若A为浓氨水,B为生石灰,滴入后反应生成氨气,氨气和铝离子反应生成氢氧化铝,但氢氧化铝不溶于氨水,所以C中产生白色沉淀不溶解,故C错误;
D.若A为浓盐酸 ,B为CaCO3,反应生成CO2,CO2与Na2SiO3溶液反应生成硅酸白色沉淀,但由于浓盐酸易挥发,挥发出的HCl,也可与Na2SiO3溶液反应生成硅酸白色沉淀,所以无法证明非金属性C>Si,故D错误;
答案为A。


科目:高中化学 来源: 题型:
【题目】
(1)写出具有下列电子排布的微粒在周期表中的位置.
①A﹣ 1s22s22p63s23p6 , 第周期第族.
②B原子 2s22p3 , 第周期第族.
(2)外围电子排布式为3d54s2的原子,其原子结构示意图为 , 其最高正价为;是第周期族.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.萃取B.蒸发C.蒸馏D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将乙酸溶液与NaOH溶液混合,所得溶液的pH=7,则此溶液中
A. c(CH3COO-)>c(Na+)
B. c(CH3COO-)<c(Na+)
C. c(CH3COO-)=c(Na+)
D. 无法确定c(CH3COO-)与c(Na+)的大小关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明。

(1)按图装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先将活塞(K1、K2)关闭好,目的何在?____。
(2)试管I内的试剂X是__时,打开活塞K1、K2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化,则所得的结论是____。
(3)试管I内试剂为CO2饱和水溶液时,其他操作同(2),通过____的现象,可以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)CO2与过氧化钠反应机理也可用示踪原子分析加以证明,请完成下列反应方程式:
__Na2O2+____C18O2+____H218O→____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳的化合物之间很容易发生转化.请回答下列问题:
(1)有机物 M 在有光的时候很容易转化成 N,其过程如图: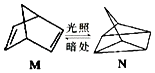
M 到 N 过程中,光能转化为能;其中较稳定的物质是(用 M、N 回答).
(2)已知 ![]() (l)的燃烧热为 3267.5kJmol﹣1 ,
(l)的燃烧热为 3267.5kJmol﹣1 , ![]() (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)
△H=a kJmol﹣1 , 则 a﹣3267.5(填“>”、“<”或“=”).
(3)在标准状态即压力为 100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化 合物时的反应热称为该化合物的标准摩尔生成焓(△H¢).已知 100kPa,一定温度下:
Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO 2(g)△H=﹣280.0kJmol﹣1
O2(g)=CO 2(g)△H=﹣280.0kJmol﹣1
C(石墨)+O2(g)=CO2 (g)△H=﹣390.5kJmol﹣1
则 Fe2O3的标准摩尔生成焓△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度条件下,Bodensteins 研究了反应:2HI(g)H2(g)+I2(g),气体 混合物中 HI 的物质的量分数 x(HI)与反应时间 t 的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(1)根据上述实验结果,该反应的平衡常数 K 的计算式为 .
(2)上述反应,正反应速率为 v 正=k 正 x2(HI),逆反应速率为 v 逆=k 逆 x(H2)x(I2),其中 k 正k 逆为速率常数,则 k 逆为(以 K 和 k 正表示).若 k 正=0.002 min,第一次试验时,v(正)=min.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.18gH2O含有的氢原子数目为NA
B.标准状况下,22.4LCO2含有的分子数目为NA
C.1L1molL﹣1K2SO4溶液中含有的钾离子数目为NA
D.1molH2在O2中完全燃烧转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的价电子排布式是3s23p4,则它在周期表中的位置是 ( )
A. 第二周期第ⅣA族 B. 第三周期第ⅣA族
C. 第四周期第ⅡA族 D. 第三周期第ⅥA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com