
����Ŀ����ijһ�¶������£�Bodensteins �о��˷�Ӧ��2HI��g��H2��g��+I2��g�������� ������� HI �����ʵ������� x��HI���뷴Ӧʱ�� t �Ĺ�ϵ�����
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
��һ������ | x��HI�� | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
�ڶ������� | x��HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
��1����������ʵ�������÷�Ӧ��ƽ�ⳣ�� K �ļ���ʽΪ ��
��2��������Ӧ������Ӧ����Ϊ v ��=k �� x2��HI�����淴Ӧ����Ϊ v ��=k �� x��H2��x��I2�������� k ��k ��Ϊ���ʳ������� k ��Ϊ���� K �� k ����ʾ������ k ��=0.002 min����һ������ʱ��v������=min��
���𰸡�
��1��![]()
��2��![]() ,1.95��10��3
,1.95��10��3
���������⣺��1�����е�һ�У���HI�ֽ⽨��ƽ�⣬���еڶ������淴Ӧ���н���ƽ�⣬�ɵ�һ�����ݿ�֪��ƽ��ʱHI���ʵ�������Ϊ0.784���������������������ʵ�������Ϊ1��0.784=0.216��������������������ʵ���������Ⱦ�Ϊ0.108����Ӧǰ������������䣬�����ʵ�����������Ũ�ȼ���ƽ�ⳣ������ƽ�ⳣ��K= ![]() =
= ![]() ��
��
���Դ��ǣ� ![]() ��
��
��2������ƽ��ʱ�������淴Ӧ������ȣ���k��x2��HI��=k��x��H2��x��I2������k��=k���� ![]() =
= ![]() ��
��
��t=40minʱ������Ӧ����ƽ���x��HI��=0.85����v��=k��x2��HI��=0.0027min��1��0.852=1.95��10��3min��1��
���Դ��ǣ� ![]() ��1.95��10��3��
��1.95��10��3��
�����㾫����ͨ��������û�ѧƽ��ļ��㣬���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪��
��XԪ��ԭ�Ӽ۵����Ų�ʽΪns2np2 �� ��ԭ�Ӱ뾶��ͬ��Ԫ������С�ģ�
��YԪ���ǵؿ��к�������Ԫ�أ�WԪ�صĵ縺����С��YԪ�أ���Wԭ�ӵĵ����Ų��У�p�����ֻ��1��δ�ɶԵ��ӣ�
��ZԪ�صĵ��������ݼ�����kJ/mol����
I1 | I2 | I3 | I4 | �� |
496 | 4562 | 6912 | 9540 | �� |
��ش�
��1��Z2Y2�ĵ���ʽΪ �� ���еĻ�ѧ������ �� Z2Y2Ϊ���壮
��2��X��Y��Z����Ԫ�����γɵij��������������Ϊ��XY2�ĽṹʽΪ �� �������幹��Ϊ ��
��3��X��Y��Z��W����Ԫ�����γɵĵ����У��۵���ߡ�Ӳ���������������ƣ�������ZW���۵�Ⱦ���XW4���Ըߵ�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��������N2��H2O��Na2O2��CaCl2��KOH��NaF�У��Ⱥ������Ӽ����ֺ��й��ۼ���������_______�����ڹ��ۻ��������__________��
(2)�õ���ʽ��ʾCaCl2���γɹ���: __________��
(3)������(Na3N)�ǿ�ѧ���Ʊ�������Ҫ���������ˮ���ò���NH3����д��Na3N�ĵ���ʽ��__________��
(4)Na3N�����ᷴӦ���������Σ���Ӧ�Ļ�ѧ����ʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʵ��װ�ã���Һ��A��μ��뵽����B�У�����������ȷ����

A. ��AΪH2O2��BΪMnO2��C��Na2S��Һ�����
B. ��AΪŨ���ᣬBΪMnO2��C��KI������Һ����ɫ
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��AlCl 3��Һ�Ȳ�����ɫ������ �������ܽ�
D. ��AΪŨ���� ��BΪCaCO3��C��Na2SiO3 ��Һ���ְ�ɫ��������ǽ�����C��Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���E��ҽҩ�ϳ��м��塣��ϳ�·�����£�

��1��![]() �Ĺ���������Ϊ_____________��E�ķ���ʽΪ_______________��
�Ĺ���������Ϊ_____________��E�ķ���ʽΪ_______________��
��2��B��D�Ĺ����У�B���ӵ��Ȼ�ȫ��������д���÷�Ӧ����ʽ��_________________��
��3��D��E�ķ�Ӧ�������£�

д����Ӧ��ķ�Ӧ���ͣ���_____________����_____________
��4��д����������������A������ͬ���칹��Ľṹ��ʽ___________________��
a����������������ͭ����Һ��Ӧ����ש��ɫ����
b������������Na2CO3��Ӧ���ͷų�����
��5����д����CH2=CH2Ϊ��Ҫԭ�ϣ����Լ����ã��Ʊ�OHC��CHO���Ҷ�ȩ���ĺϳ�·������ͼ����ע����Ӧ������_______�����ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B����
B����![]() Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡþ���ɰ����²�����У�
�ٰѱ����Ƴ�ʯ����
��������ĺ�ˮ�м���ʯ���飬���������ˣ�ϴ�ӳ�����
�۽������������ᷴӦ���ᾧ���ˣ��������
��ұ���۵IJ���õ�����Mg
������ȡþ������˵������ȷ����
A. �˷����ŵ�֮һ��ԭ����Դ�ḻ
B. ���Т٢ڢ۲����Ŀ���ǴӺ�ˮ����ȡMgCl2
C. �â۵IJ���ұ������Mg���������Ȼ�ԭ������ԭ��C��CO��H2��
D. ������ȡþ�Ĺ������漰�ķ�Ӧ�зֽⷴӦ�����Ϸ�Ӧ���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�������H2O������̼������ɱ�ĺ�ѹ�ܱ������з�����Ӧ:
C(s)+H2O (g) ![]() CO(g)+H2(g)��H�����ѹǿ���¶ȶ�CO��ƽ����ɵ�Ӱ����ͼ��ʾ��
CO(g)+H2(g)��H�����ѹǿ���¶ȶ�CO��ƽ����ɵ�Ӱ����ͼ��ʾ��

��1����֪:2H2 (g)+O2(g)==2H2O (g) ��H1
2CO(g)+ O2 (g)==2CO2(g)��H2
C(s)+ O2 (g)==CO2(g) ��H3
����H=_________(�ú���H1����H2����H3��ʽ�ӱ�ʾ)��
��2�������д�ʩ�ܹ����H2���ʵ���_______(����)
a.��ѹ b.�����CO C.���� d.����̼�������
��a��b��c��������Ӧ��ˮ��ת������С����______________��
��3��700����P3ʱ����1molH2O������̼�����ʼ���Ϊ1L���ܱ������У����¡���ѹ�����£�����Ӧ���е�10minʱ�����������H2�����ʵ���Ϊ0.12mol��
��10min��CO��ƽ����Ӧ����Ϊ__________________ mol��L-1��min-1(������λ��Ч����)��
�ڴ��¶��¸÷�Ӧ��ƽ�ⳣ��K___________��
����������Ͷ�Ϻ�����ͼ�л�����0ʱ�̵�t1ʱ�̴ﵽƽ��ʱ�����л�������ƽ��Ħ�������ı仯���ߡ�___________________

�ܴ�t1ʱ�̿�ʼ�������¶Ȳ��䣬��������ѹ���������ƽ��Ħ��������t2ʱ�̺�仯����ͼ�����ָñ仯��ԭ����____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�ÿ��Բⶨͭпԭ��ع���ʱת�Ƶ��ӵ����ʵ�����������Ͳ�������㹻��пƬ��ͭƬ�������ʣ����������ת��Ϊ��״��������˵����ȷ���ǣ�������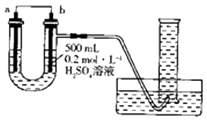
A.a�缫�ĵ缫������ͭ
B.�����ϡ���ỻΪCuSO4��Һ�����ܴﵽʵ��Ŀ��
C.п��ϡ���ᷴӦʱ�ų���������ʵ��ⶨ������Ӱ��
D.����Ͳ���ռ���a L H2 �� ��������Һ��ͨ���� ![]() mol����
mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ���ǣ�������
A.![]() 2���һ�����
2���һ�����
B.CH3CH2CH2OH 1������
C.![]() ����ױ�
����ױ�
D.![]() 2������2����ϩ
2������2����ϩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com