
【题目】利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )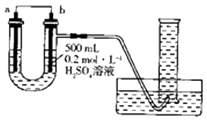
A.a电极的电极材料是铜
B.如果将稀硫酸换为CuSO4溶液,则不能达到实验目的
C.锌与稀硫酸反应时放出的热量对实验测定不产生影响
D.若量筒中收集到a L H2 , 则电解质溶液中通过了 ![]() mol电子
mol电子
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.萃取B.蒸发C.蒸馏D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度条件下,Bodensteins 研究了反应:2HI(g)H2(g)+I2(g),气体 混合物中 HI 的物质的量分数 x(HI)与反应时间 t 的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(1)根据上述实验结果,该反应的平衡常数 K 的计算式为 .
(2)上述反应,正反应速率为 v 正=k 正 x2(HI),逆反应速率为 v 逆=k 逆 x(H2)x(I2),其中 k 正k 逆为速率常数,则 k 逆为(以 K 和 k 正表示).若 k 正=0.002 min,第一次试验时,v(正)=min.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.18gH2O含有的氢原子数目为NA
B.标准状况下,22.4LCO2含有的分子数目为NA
C.1L1molL﹣1K2SO4溶液中含有的钾离子数目为NA
D.1molH2在O2中完全燃烧转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质的递变情况错误的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正价依次升高
C. N、O、F第一电离能依次增大
D. Na、K、Rb电负性逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制取少量乙酸乙酯,下列说法正确的是

A. 实验时向a中先加浓硫酸再加乙醇和乙酸
B. 加入浓硫酸并加热起到了加快反应速率的作用
C. 试管b中试剂为饱和NaOH溶液,可除去乙酸和乙醇
D. 实验结束时,采用蒸发的方法将乙酸乙酯从混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100mL 0.50 mol·L-1 NaOH溶液时,必须用到的仪器是
A.100mL容量瓶B.100mL集气瓶C.100mL烧瓶D.100mL滴瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的价电子排布式是3s23p4,则它在周期表中的位置是 ( )
A. 第二周期第ⅣA族 B. 第三周期第ⅣA族
C. 第四周期第ⅡA族 D. 第三周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解实验装置,X、Y都是惰性电极,a是滴有酚酞的饱和NaCl溶液。下列有关实验的说法正确的是

A. X电极为阳极,Y电极为阴极
B. X电极溶液先变红色,且有刺激性气味气体产生
C. 将X、Y两极产生的气体收集起来,相同条件下其体积比略大于1:1
D. 电解后,将溶液混匀,电解前后溶液的pH未发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com