
【题目】现将定量的H2O与足量碳在体积可变的恒压密闭容器中发生反应:
C(s)+H2O (g) ![]() CO(g)+H2(g)△H,测得压强、温度对CO的平衡组成的影响如图所示。
CO(g)+H2(g)△H,测得压强、温度对CO的平衡组成的影响如图所示。

(1)已知:2H2 (g)+O2(g)==2H2O (g) △H1
2CO(g)+ O2 (g)==2CO2(g)△H2
C(s)+ O2 (g)==CO2(g) △H3
则△H=_________(用含△H1、△H2、△H3的式子表示)。
(2)①下列措施能够提高H2产率的是_______(填标号)
a.加压 b.分离出CO C.加热 d.增大碳固体的量
②a、b、c三点所对应的水的转化率最小的是______________。
(3)700℃、P3时,将1molH2O与足量碳充入初始体积为1L的密闭容器中,恒温、恒压条件下,当反应进行到10min时,测得容器中H2的物质的量为0.12mol。
①10min内CO的平均反应速率为__________________ mol·L-1·min-1(保留两位有效数字)。
②此温度下该反应的平衡常数K___________。
③向容器中投料后,在下图中画出从0时刻到t1时刻达到平衡时容器中混合气体的平均摩尔质量的变化曲线。___________________

④从t1时刻开始,保持温度不变,对容器加压,混合气体平均摩尔质量从t2时刻后变化如上图,出现该变化的原因是____________________________________________。
【答案】 △H3-1/2△H1-1/2△H2 bc b 0.011 0.8 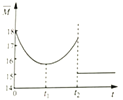 (起点必须
(起点必须![]() =18开始) 压强增大,水蒸气液化
=18开始) 压强增大,水蒸气液化
【解析】(1)已知:①2H2 (g)+O2(g)==2H2O (g) △H1;②2CO(g)+ O2 (g)==2CO2(g)△H2;③C(s)+ O2 (g)==CO2(g) △H3;根据盖斯定律,由③-![]() ×①-
×①-![]() ×②得反应C(s)+H2O (g)
×②得反应C(s)+H2O (g) ![]() CO(g)+H2(g) △H=△H3-
CO(g)+H2(g) △H=△H3-![]() △H1-
△H1-![]() △H2;(2)①由图中信息可知,升高温度,CO的体积分数增大,则正反应为吸热反应,反应C(s)+H2O (g)
△H2;(2)①由图中信息可知,升高温度,CO的体积分数增大,则正反应为吸热反应,反应C(s)+H2O (g) ![]() CO(g)+H2(g)为气体体积增大的吸热反应。a.加压,平衡逆向移动,降低氢气的产率,故错误;b.分离出CO,平衡正向移动,提高氢气的产率,故正确;c.加热,平衡正向移动,提高氢气的产率,故正确;d.增大碳固体的量,反应物浓度不变,平衡不移动,故错误。答案选bc;②温度相同,a点CO的体积分数大于b点,则水的转化率a点较大,正反应为吸热反应,c点温度高于a点,升高温度平衡正向移动水的转化率增大,故三点对应的水的转化率最小的是b;(3)700℃、P3时,CO的体积分数为40%, C(s)+H2O (g)
CO(g)+H2(g)为气体体积增大的吸热反应。a.加压,平衡逆向移动,降低氢气的产率,故错误;b.分离出CO,平衡正向移动,提高氢气的产率,故正确;c.加热,平衡正向移动,提高氢气的产率,故正确;d.增大碳固体的量,反应物浓度不变,平衡不移动,故错误。答案选bc;②温度相同,a点CO的体积分数大于b点,则水的转化率a点较大,正反应为吸热反应,c点温度高于a点,升高温度平衡正向移动水的转化率增大,故三点对应的水的转化率最小的是b;(3)700℃、P3时,CO的体积分数为40%, C(s)+H2O (g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
开始时的量(mol) 1 0 0
改变的量(mol) 0.12 0.12 0.12
平衡时的量(mol) 0.88 0.12 0.12
反应后容器的体积为![]() ,①10min内CO的平均反应速率为
,①10min内CO的平均反应速率为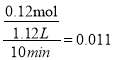 mol·L-1·min-1;②此温度下该反应的平衡常数K=
mol·L-1·min-1;②此温度下该反应的平衡常数K=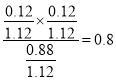 ;③向容器中投料后,在下图中画出从0时刻到t1时刻达到平衡时容器中混合气体的平均摩尔质量的变化曲线,开始时为水的摩尔质量18g/mol,随着反应的进行气体的体积增大,平均摩尔质量减小,故图如下:
;③向容器中投料后,在下图中画出从0时刻到t1时刻达到平衡时容器中混合气体的平均摩尔质量的变化曲线,开始时为水的摩尔质量18g/mol,随着反应的进行气体的体积增大,平均摩尔质量减小,故图如下: ;④从t1时刻开始,保持温度不变,对容器加压,混合气体平均摩尔质量从t2时刻后变化如上图,出现该变化的原因是压强增大,水蒸气液化。
;④从t1时刻开始,保持温度不变,对容器加压,混合气体平均摩尔质量从t2时刻后变化如上图,出现该变化的原因是压强增大,水蒸气液化。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明。

(1)按图装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先将活塞(K1、K2)关闭好,目的何在?____。
(2)试管I内的试剂X是__时,打开活塞K1、K2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化,则所得的结论是____。
(3)试管I内试剂为CO2饱和水溶液时,其他操作同(2),通过____的现象,可以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)CO2与过氧化钠反应机理也可用示踪原子分析加以证明,请完成下列反应方程式:
__Na2O2+____C18O2+____H218O→____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度条件下,Bodensteins 研究了反应:2HI(g)H2(g)+I2(g),气体 混合物中 HI 的物质的量分数 x(HI)与反应时间 t 的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(1)根据上述实验结果,该反应的平衡常数 K 的计算式为 .
(2)上述反应,正反应速率为 v 正=k 正 x2(HI),逆反应速率为 v 逆=k 逆 x(H2)x(I2),其中 k 正k 逆为速率常数,则 k 逆为(以 K 和 k 正表示).若 k 正=0.002 min,第一次试验时,v(正)=min.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的原子核外有三个电子层,K层电子数为a,L层电子数为b,M层电子数为b-a,该原子核内的质子数是(
A. 14 B. 15 C. 16 D. 17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.18gH2O含有的氢原子数目为NA
B.标准状况下,22.4LCO2含有的分子数目为NA
C.1L1molL﹣1K2SO4溶液中含有的钾离子数目为NA
D.1molH2在O2中完全燃烧转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质的递变情况错误的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正价依次升高
C. N、O、F第一电离能依次增大
D. Na、K、Rb电负性逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100mL 0.50 mol·L-1 NaOH溶液时,必须用到的仪器是
A.100mL容量瓶B.100mL集气瓶C.100mL烧瓶D.100mL滴瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用Na2SO4溶液沉淀Ba2+、Pb2+、Ca2+三种金属离子(M2+),所需SO42-最低浓度的对数值p(SO42-)=-lgc(SO42-)与p(M2+)=-lgc(M2+)关系如图所示。下列说法正确的是

A. KSP(CaSO4)<KSP(PbSO4)<KSP(BaSO4)
B. a点可表示CaSO4的饱和溶液,且c(Ca2+)=c(SO42-)
C. b点可表示PbSO4的不饱和溶液,且c(Pb2+)<c(SO42-)
D. 向Ba2+浓度为10-5mol·L-1的废水中加入CaSO4粉末,会有BaSO4沉淀析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com