

| A、分子式是C13H14O4Cl2 |
| B、1mol利尿酸最多能与5mol H2发生加成反应 |
| C、-定条件下能发生加聚、缩聚反应 |
| D、分子中所有碳原子不可能共平面 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
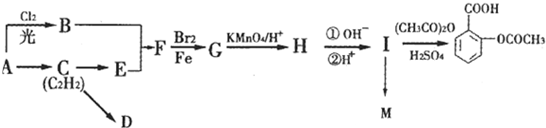
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 |
| B、向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 |
| C、将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 陈述I | 陈述Ⅱ | |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | Cl2使润湿的有色布条褪色,而干燥的布条不褪色 | 次氯酸的氧化性比氯气的强 |
| D | 稀、浓HNO3分别与铜反应,还原产物为NO和NO2 | 稀HNO3氧化性比浓HNO3强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2所占体积约为22.4 L |
| B、22 g CO2中含有的分子数约为6.02×1023 |
| C、100 mL 0.5 mol/L NaOH溶液中含溶质的质量为0.05 g |
| D、标准状况下,11.2 L O2和H2的混合气体所含分子数约为3.01×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com