
|
| 1 |
| 2 |
| 2.8×10 -9 |
| 1×10 -4 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、c(OH-)>c(HA)>c(HB)>c(H+) |
| B、c(OH-)>c(A-)>c(B-)>c(H+) |
| C、c(OH-)>c(B-)>c(A-)>c(H+) |
| D、c(OH-)>c(HB)>c(HA)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式是C13H14O4Cl2 |
| B、1mol利尿酸最多能与5mol H2发生加成反应 |
| C、-定条件下能发生加聚、缩聚反应 |
| D、分子中所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
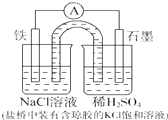
| A、Fe作负极,发生氧化反应 |
| B、盐桥的作用是平衡电荷,构成闭合回路 |
| C、工作一段时间后,NaCl溶液中c(Cl-)不变 |
| D、正极反应:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu的活动性排在H之后,不能与浓H2SO4发生反应 |
| B、金刚石是自然界中硬度最大的物质,不能氧气发生反应 |
| C、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Mg2+、Cl-、NO3- |
| B、Ba2+、SO42-、Cl-、OH- |
| C、K+、OH-、CO32-、MnO4- |
| D、Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度(mol/L) 时间(min) | NO | N2 | NO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com