
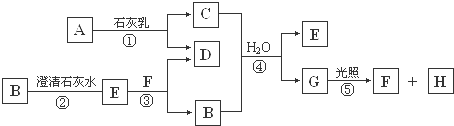
 ,故答案为:
,故答案为: ;
;
| ||
| ||
 ,
, .
.


科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为 |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是 |
| (3)将KCl加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验方案 |
| A | 验证Ksp(AgCl)>Ksp(AgI) | 向NaCl溶液中滴加AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置.可观察到下层液体呈紫色 |
| D | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
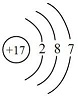
查看答案和解析>>
科目:高中化学 来源: 题型:
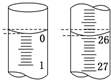
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Mg2+、NO3- |
| B、CO32-、Cl-、Mg2+ |
| C、Cl-、SO42-、K+ |
| D、Cu2+、Ca2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,Zn作负极,发生还原反应 |
| B、放电时,K2FeO4附近溶液pH减小 |
| C、充电时,锌极附近溶液pH减小 |
| D、充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
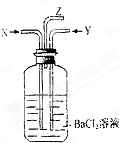 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )| A、洗气瓶中产生的沉淀是BaCO3 |
| B、在Z导管出来的气体中无CO2 |
| C、洗气瓶中产生的沉淀是BaSO3 |
| D、在Z导管口有红棕色气体出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com