
【题目】在元素周期表中金属与非金属的分界处,可以找到
A.合金材料B.催化剂C.农药D.半导体材料
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】维生素C又名抗坏血酸,结构简式为 .维生素C在碱性溶液中易被氧化,能被I2定量氧化
.维生素C在碱性溶液中易被氧化,能被I2定量氧化 测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
步骤一:将1.3 g I2溶于少量KI浓溶液,转入1000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
步骤三:准确移取10.00 mL果汁,加入20 mL l%草酸溶液和1mL l%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100g橙子中维生素C的含量。
(1)步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是____________,所需要的玻璃仪器有烧杯、1000 mL容量瓶、_____;
(2)步骤二中加入活性炭的作用是____;抽滤使用的主要仪器是____;
(3)在步骤二和步骤三中均加入草酸溶液的目的是___________;
(4)步骤二和步骤三通常需控制在2分钟内完成,若超时会导致测定结果 ________填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是( )
A.钛合金B.二氧化硅C.晶体硅D.氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一次有机化学课堂小组讨论中,某同学设计了下列合成路线,你认为不可行的是( )
A. 用氯苯合成环己烯:![]()
B. 用甲苯合成苯甲醇:![]()
C. 用乙烯合成乙酸:![]()
D. 用乙烯合成乙二醇:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置有多种,其中的三种如下
I:中学教材中苯与溴发生反应的装置如图1所示。
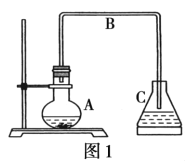
A中加入15mL无水苯和少量铁屑。再小心加入4.0mL液态溴。
根据相关知识回答下列问题
(1)装置中发生反应的化学方程式为_____________。
(2)C的作用为_____________
Ⅱ:改进的苯与溴发生反应的装置如图2所示。根据要求填空
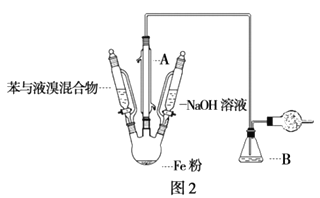
(3)将三颈烧瓶内反应后的液体分离出的操作是_____________(填操作名称);将液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;⑤_____________(填操作名称)。
(4)干燥管中所装试剂是_____________
III:另一种改进装置如图3,试根据要求回答
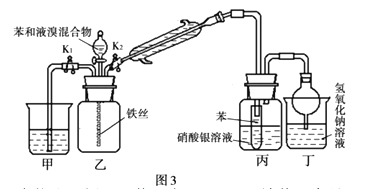
(5)整套实验装置中能防止倒吸的装置有_____________(填装置序号)。
(6)冷凝管所起的作用为冷凝回流和导气,冷凝水从_____________口进入(填“上”或“下”)。
(7)反应结束后要使装置甲中的水倒吸入装置乙中,这样操作的目的是_____________
(8)若实验时,无液溴,但实验室有溴水,该实验如何操作才能做成功。_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 在离子化合物中一定含有金属元素
B. 在离子化合物中不可能存在非极性键
C. 共价化合物中一定没有金属元素
D. 共价化合物中可能既有极性键也有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施可以提高燃料燃烧效果的是( ) ①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入足量的空气.
A.①③
B.①②③
C.①③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】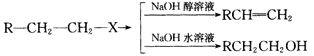
利用上述信息,按以下步骤从![]() 合成
合成![]() (部分试剂和反应条件已略去):
(部分试剂和反应条件已略去):
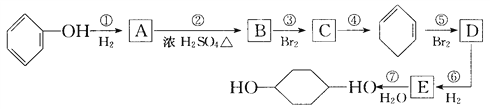
请回答下列问题:
(1)分别写出A、C、D的结构简式:
A:____________;C:____________;D:____________。
(2)如果不考虑⑥、⑦反应,对于反应⑤得到D的另一种可能结构简式为_______________。
(3)写出反应②、⑦的化学方程式:__________________;______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法正确的是:

A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
D.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com