
【题目】维生素C又名抗坏血酸,结构简式为 .维生素C在碱性溶液中易被氧化,能被I2定量氧化
.维生素C在碱性溶液中易被氧化,能被I2定量氧化 测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
步骤一:将1.3 g I2溶于少量KI浓溶液,转入1000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
步骤三:准确移取10.00 mL果汁,加入20 mL l%草酸溶液和1mL l%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100g橙子中维生素C的含量。
(1)步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是____________,所需要的玻璃仪器有烧杯、1000 mL容量瓶、_____;
(2)步骤二中加入活性炭的作用是____;抽滤使用的主要仪器是____;
(3)在步骤二和步骤三中均加入草酸溶液的目的是___________;
(4)步骤二和步骤三通常需控制在2分钟内完成,若超时会导致测定结果 ________填“偏大”、“偏小”或“无影响”)。
【答案】 促进I2的溶解 胶头滴管、玻璃棒 吸附果汁中的有色物质,以免干扰步骤三滴定终点的观察 布氏漏斗 提供酸性环境防止维生素C被氧化 偏小
【解析】(1)步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是促进I2的溶解,所需要的玻璃仪器有烧杯、1000 mL容量瓶、胶头滴管、玻璃棒;(2)步骤二中加入活性炭的作用是吸附果汁中的有色物质,以免干扰步骤三滴定终点的观察;抽滤使用的主要仪器是布氏漏斗;(3)在步骤二和步骤三中均加入草酸溶液的目的是提供酸性环境防止维生素C被氧化;(4)步骤二和步骤三通常需控制在2分钟内完成,若超时维生素C会被空气中的氧气氧化,会导致测定结果偏小。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】20种氨基酸平均相对分子质量为128,某蛋白质相对分子质量为10228,在形成该蛋白质分子时脱去86个水分子。那么组成该蛋质的肽链数是
A. 4 条 B. 6 条 C. 8 条 D. 16 条
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)已知反应:①C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
写出表示CO燃烧热的热化学方程式 .
(2)搭载神舟十一号航天飞船的长征二号F运载火箭的助推器、芯一级、芯二级应用的燃料全部是液态偏二甲肼和液态四氧化二氮.其中偏二甲肼(C2H8N2)为火箭燃料,四氧化二氮(N2O4)为氧化剂,当它们混合时,立即产生大量氮气、二氧化碳和水蒸气,并放出大量热. 若0.1mol 偏二甲肼与N2O4完全反应时,放出 526.65kJ的热量.写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
B.己烷有4种同分异构体,它们的熔点、沸点各不相同
C.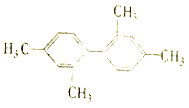 分子中至少有11个碳原子处于同一平面
分子中至少有11个碳原子处于同一平面
D.聚合物 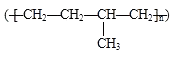 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C8H8 , 经研究表明该有机物不能发生加成反应和加聚反应.在常温下难于被酸性KMnO4溶液氧化.但在一定条件下却可与Cl2发生取代反应.而且其一氯代物只有一种.下列对该有机物结构的推断中一定正确的是( )
A.该有机物中含有碳碳双键
B.该有机物属于芳香烃
C.该有机物分子具有平面环状结构
D.该有机物具有三维空间的立体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应. 2R﹣C≡C﹣H ![]() R﹣C≡C﹣C≡C﹣R+H2
R﹣C≡C﹣C≡C﹣R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值.下面是利用Glaser反应制备化合物E的一种合成路线: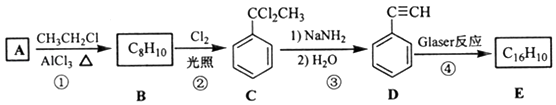
回答下列问题:
(1)B的结构简式为 , D 的化学名称为 .
(2)①和③的反应类型分别为、 .
(3)E的结构简式为 . 用1mol E合成1,4﹣二苯基丁烷,理论上需要消耗氢气mol.
(4)化合物( ![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中2种的结构简式 , .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I是重要有机中间体,其合成路线(部分反应条件已略去)如下图所示:

已知:
R — CN![]() R — COOH
R — COOH
回答下列问题:
(1)A的结构简式是______________。
(2)B中含有的官能团是______________。
(3)D是一种合成高分子,它的结构简式是______________。
(4)I发生缩聚反应的化学方程式是______________。
(5)G→H的反应类型是______________。
(6)E→F反应的化学方程式是______________。
(7)下列说法正确的是________。
①物质I能发生消去反应
②F→G过程产生的副产物 物质G互为同分异构体
物质G互为同分异构体
③B、D均存在顺反异构
(8)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)________。(合成路线常用的表示方式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生产硝酸、尿素等物质的重要原料。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g) ![]() 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol
2H2(g)+02(g)![]() 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol
则4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H3=__________
4NO(g)+6H2O(g) △H3=__________
(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g)![]() 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
温度/K | 298 | 398 | 498 | … |
平衡常数(K) | 4.1×106 | K1 | K2 | … |
K1____K2(填“>”或“<”),其判断理由是_____________。
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。

①下列说法正确的是______(填字母)。
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为__________。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为_______。
(5)氮碳比[![]() ]对合成尿素的反应:2NH3(g)+CO2(g)
]对合成尿素的反应:2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当![]() =_______时,尿素的产量最大,该条件下反应的平衡常数K=________。
=_______时,尿素的产量最大,该条件下反应的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com