
【题目】下列说法不正确的是( )
A.在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
B.己烷有4种同分异构体,它们的熔点、沸点各不相同
C.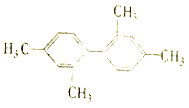 分子中至少有11个碳原子处于同一平面
分子中至少有11个碳原子处于同一平面
D.聚合物 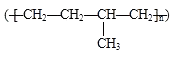 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
【答案】B
【解析】解:A.苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应,苯环的H原子被其它原子或原子团替代,为取代反应,故A正确;
B.己烷有五种同分异构体,其碳链结构分别为 ![]() 、
、 ![]() 、
、 ![]() 、
、  、
、 ![]() ,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故B错误;
,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故B错误;
C.甲基至少有1个碳原子与苯环共面,苯环上所有的原子共面以及苯环上处于对称位置上的4个原子共线,所以 ![]() 分子中至少有11个碳原子处于同一平面,故C正确;
分子中至少有11个碳原子处于同一平面,故C正确;
D.由结构简式可知, 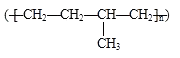 可由CH3CH=CH2和CH2=CH2发生加聚反应生成,故D正确.
可由CH3CH=CH2和CH2=CH2发生加聚反应生成,故D正确.
故选B.
【考点精析】认真审题,首先需要了解有机物的结构和性质(有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解).


科目:高中化学 来源: 题型:
【题目】达康书记又追问环保局长:那么垃圾处理中,能随便焚烧吗?焚烧垃圾会降低GDP的。在焚烧垃圾过程中发生了( )
A.吸热的氧化还原反应
B.吸热的非氧化还原反应
C.放热的氧化还原反应
D.放热的非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体A受热易分解,实验流程和结果如下:

B和C为常见气体且所含元素相同。气体C在标准状况下密度为1.96g·L-1。请回答:
(1)白色沉淀的化学式___________________。
(2)写出A受热分解的化学方程式___________________。
(3)取少量固体D溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀。写出产生该现象的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对现行的元素周期表的说法中正确的是( )
A.元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的
B.最外层电子数相同的元素都是同一族
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。其实验操作为预先使棉花团浸透乙醇,并按照图示安装好装置;在铜丝的中间部分加热,片刻后开始(间歇性)鼓入空气,即可观察到明显的实验现象。

请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为________________________________。
(2)从A管中可观察到____________的实验现象。从中可认识到在该实验过程中,催化剂参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______________________。
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?__________,原受热部分的铜丝有什么现象?____________,产生这种现象是因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性B.该粒子质量比氢原子大
C.该粒子质量数为4D.在周期表中与氢元素占同一位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又名抗坏血酸,结构简式为 .维生素C在碱性溶液中易被氧化,能被I2定量氧化
.维生素C在碱性溶液中易被氧化,能被I2定量氧化 测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
步骤一:将1.3 g I2溶于少量KI浓溶液,转入1000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
步骤三:准确移取10.00 mL果汁,加入20 mL l%草酸溶液和1mL l%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100g橙子中维生素C的含量。
(1)步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是____________,所需要的玻璃仪器有烧杯、1000 mL容量瓶、_____;
(2)步骤二中加入活性炭的作用是____;抽滤使用的主要仪器是____;
(3)在步骤二和步骤三中均加入草酸溶液的目的是___________;
(4)步骤二和步骤三通常需控制在2分钟内完成,若超时会导致测定结果 ________填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应制备:C6H6 + HNO3 ![]() C6H5—NO2 + H2O ΔH < 0。已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
C6H5—NO2 + H2O ΔH < 0。已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
物质 | 苯 | 硝基苯 | 间二硝基苯 | 浓硝酸 | 浓硫酸 |
沸点/℃ | 80 | 211 | 301 | 83 | 338 |
溶解性 | 微溶于水 | 难溶于水 | 微溶于水 | 易溶于水 | 易溶于水 |
下列说法不正确的是
A. 制备硝基苯的反应类型为取代反应
B. 采用蒸馏的方法可将硝基苯从反应所得产物中首先分离出来
C. 该反应温度控制在50-60℃的原因是减少反应物的挥发和副产物的生成
D. 采用加入NaOH溶液、水洗涤、以及分液的方法可除去粗硝基苯中混有的无机杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示[已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJ/mol]. 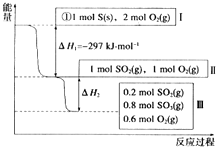
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: .
②△H2= kJ/mol.
③在相同条件下,充入1mol SO3和0.5mol O2 , 则达到平衡时SO3的转化率为;此时该反应(填“放出”或“吸收”) kJ的能量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com