
����Ŀ����������һ����Ҫ�л��ϳ��м��壬ʵ���ҿ������·�Ӧ�Ʊ���C6H6 + HNO3 ![]() C6H5��NO2 + H2O ��H < 0����֪�÷�Ӧ���¶��Ըߵ�����»����ɼ�����������й��������±���
C6H5��NO2 + H2O ��H < 0����֪�÷�Ӧ���¶��Ըߵ�����»����ɼ�����������й��������±���
���� | �� | ������ | ��������� | Ũ���� | Ũ���� |
�е�/�� | 80 | 211 | 301 | 83 | 338 |
�ܽ��� | ����ˮ | ������ˮ | ����ˮ | ������ˮ | ������ˮ |
����˵������ȷ����
A. �Ʊ��������ķ�Ӧ����Ϊȡ����Ӧ
B. ��������ķ����ɽ��������ӷ�Ӧ���ò��������ȷ������
C. �÷�Ӧ�¶ȿ�����50-60���ԭ���Ǽ��ٷ�Ӧ��Ļӷ������������
D. ���ü���NaOH��Һ��ˮϴ�ӡ��Լ���Һ�ķ����ɳ�ȥ���������л��е�������
���𰸡�B
��������A. �Ʊ��������DZ���Ũ���ᷴӦ������������ˮ����Ӧ����Ϊȡ����Ӧ��ѡ��A��ȷ��B�������������ķе���ڱ�����������ķ������ܽ��������ӷ�Ӧ���ò��������ȷ��������ѡ��B����ȷ��C���÷�Ӧ�¶ȿ�����50-60���ԭ���Ǽ��ٷ�Ӧ��Ļӷ�����������ɣ�ѡ��C��ȷ��D�����ü���NaOH��Һ��ˮϴ�ӡ��Լ���Һ�ķ����ɳ�ȥ���������л��е������ʣ���ȥ�������ᡢ���ἰ�������Σ�ѡ��D��ȷ����ѡB��


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ȳ�ͬѹǿ��P1��P2���£����淴Ӧ2X��g��2Y��g��+Z��g���У�������Z�ڷ�Ӧ������е�����������ף��뷴Ӧʱ�䣨t���Ĺ�ϵ������ͼʾ����ȷ���ǣ�������
A.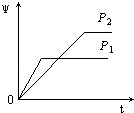
B.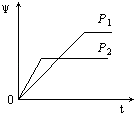
C.
D.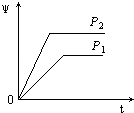
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A.��һ�������£����ֱ���Һ�塢���ᡢ�������������屽����������������ķ�Ӧ������ȡ����Ӧ
B.������4��ͬ���칹�壬���ǵ��۵㡢�е������ͬ
C.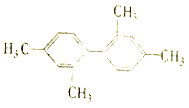 ������������11��̼ԭ�Ӵ���ͬһƽ��
������������11��̼ԭ�Ӵ���ͬһƽ��
D.�ۺ��� 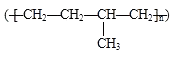 ���ɵ���CH3CH=CH2��CH2=CH2�Ӿ��Ƶ�
���ɵ���CH3CH=CH2��CH2=CH2�Ӿ��Ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ķ���ʽΪC8H8 �� ���о��������л��ﲻ�ܷ����ӳɷ�Ӧ�ͼӾ۷�Ӧ���ڳ��������ڱ�����KMnO4��Һ����������һ��������ȴ����Cl2����ȡ����Ӧ��������һ�ȴ���ֻ��һ�֣����жԸ��л���ṹ���ƶ���һ����ȷ���ǣ�������
A.���л����к���̼̼˫��
B.���л������ڷ�����
C.���л�����Ӿ���ƽ�滷״�ṹ
D.���л��������ά�ռ������ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ���ڴ��������¿ɷ���ż����Ӧ����ΪGlaser��Ӧ�� 2R��C��C��H ![]() R��C��C��C��C��R+H2
R��C��C��C��C��R+H2
�÷�Ӧ���о����ͷ�����ϡ������ӻ�ѧ�ȷ��������Ҫ��ֵ������������Glaser��Ӧ�Ʊ�������E��һ�ֺϳ�·�ߣ�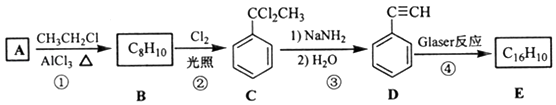
�ش��������⣺
��1��B�Ľṹ��ʽΪ �� D �Ļ�ѧ����Ϊ ��
��2���ٺ͢۵ķ�Ӧ���ͷֱ�Ϊ�� ��
��3��E�Ľṹ��ʽΪ �� ��1mol E�ϳ�1��4�����������飬��������Ҫ��������mol��
��4������� ![]() ��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ ��
��Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ ��
��5�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3��1��д������2�ֵĽṹ��ʽ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��Ӧ�������仯��˵����ȷ����
A. ȼ�����ڷ��ȷ�Ӧ
B. �кͷ�Ӧ�����ȷ�Ӧ
C. ���ѻ�ѧ���ų�����
D. ��Ӧ����������������������һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���I����Ҫ�л��м��壬��ϳ�·�ߣ����ַ�Ӧ��������ȥ������ͼ��ʾ��

��֪��
R �� CN![]() R �� COOH
R �� COOH
�ش��������⣺
��1��A�Ľṹ��ʽ��______________��
��2��B�к��еĹ�������______________��
��3��D��һ�ֺϳɸ߷��ӣ����Ľṹ��ʽ��______________��
��4��I�������۷�Ӧ�Ļ�ѧ����ʽ��______________��
��5��G��H�ķ�Ӧ������______________��
��6��E��F��Ӧ�Ļ�ѧ����ʽ��______________��
��7������˵����ȷ����________��
������I�ܷ�����ȥ��Ӧ
��F��G���̲����ĸ����� ����G��Ϊͬ���칹��
����G��Ϊͬ���칹��
��B��D������˳���칹
��8����������Ϣ������ϩ��HBrΪ��ʼԭ���Ʊ����ᣬ��ƺϳ�·�ߣ������Լ���ѡ��________�����ϳ�·�߳��õı�ʾ��ʽΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ǻ���һ�����һ�������ˮƽ����Ҫ��־��������������У���ؼ���һ����ӦΪ2SO2��g��+O2��g��![]() 2SO3��g��
2SO3��g��
��1��һ�������£�SO2��O2��Ӧ10min����SO2��SO3�����ʵ���Ũ�ȷֱ�Ϊ1mol/L��3mol/L����SO2��ʼ���ʵ���Ũ��Ϊ____________________��10min������SO3��ƽ����Ӧ����v��SO3��Ϊ____��
��2�����й��ڸ÷�Ӧ��˵����ȷ����_________����ѡ����ĸ����
A.����O2��Ũ���ܼӿ췴Ӧ����
B.������ϵ�¶��ܼӿ췴Ӧ����
C.ʹ�ô����ܼӿ췴Ӧ����
D.һ�������´ﵽ��Ӧ��ʱSO2ȫ��ת��ΪSO3
��3���ڷ�Ӧ�����У���ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2mol/L��0.1 mol/L��0.2mol/L������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������___________����ѡ����ĸ����
A.O2Ϊ0.2mol/L B. SO2Ϊ0.25mol/L
C.SO3Ϊ0.4mol/L D. SO2��SO3��Ϊ0.15mol/L
��4��FeS2���ղ�����SO2�����������ᡣ��֪25�桢101KPaʱ��
2 SO2��g��+ O2��g��2SO3��g����H1=-197kJmol-1��
H2O��g���TH2O��l����H2=-44kJmol-1��
2SO2��g��+O2��g��+2H2O��g���T2H2SO4��l����H3=-545kJmol-1
��SO3��g����H2O��l����Ӧ����H2SO4��l�����Ȼ�ѧ����ʽ��____________________��
��5����ҵ�����ᣬ�ù����İ�ˮ��SO2����β���������÷�Ӧ�����ӷ���ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڵ���ʵ����� ��
A. CH4 B. ������ϡ���� C. N2 D. �����ƹ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com