
| A. | 足量铁在1molCl2中燃烧时转移电子数为2NA | |
| B. | 2L0.1mol•L-1氯化钾溶液中阴离子所带电荷数为NA | |
| C. | 1L0.1mol•L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 标准状况下,体积各为2.24L的HCl和NH3混合气体中含有的共价键数为0.25NA |
分析 A、氯气反应后变为-1价;
B、氯化钾溶液中除了氯离子外,还含有氢氧根;
C、根据物料守恒来分析;
D、标况下2.24LHCl和氨气的物质的量均为0.1mol,但HCl中含一条共价键,而氨气中含3条共价键.
解答 解:A、氯气反应后变为-1价,故1mol氯气转移2NA个电子,故A正确;
B、氯化钾溶液中除了氯离子外,还含有氢氧根,故溶液中的阴离子的物质的量大于0.2mol,则所带电荷数多于0.2NA个,故B错误;
C、碳酸根在水溶液中部分水解为HCO3-和H2CO3,根据物料守恒可知,溶液中的CO32-、HCO3-和H2CO3的个数之和为0.1NA个,故C错误;
D、标况下2.24LHCl和氨气的物质的量均为0.1mol,但HCl中含一条共价键,而氨气中含3条共价键,故0.1molHCl中含0.1NA条共价键,而0.1mol氨气中含0.3NA条共价键,故共含0.4NA条共价键,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:填空题
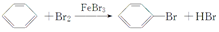 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二个反应的平衡常数为1 | |
| B. | 第二个反应的平衡常数为0.05 | |
| C. | 第二个反应达到平衡时,H2的平衡浓度为0.25mol/L | |
| D. | 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Y>Z | |
| C. | X和W形成的化合物属于离子化合物 | |
| D. | 由X、Y、Z三种元素组成的化合物一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体化学可用于制备纳米材料 | |
| B. | 钛合金主要用于尖端领域 | |
| C. | 压电陶瓷可实现化学能与电能的转化 | |
| D. | 稀土元素大大改善合金性能被称为冶金工业的维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
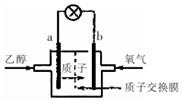 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 则该化合物的化学式为MgCNi3(用对应的元素符号表示).
则该化合物的化学式为MgCNi3(用对应的元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com