
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
| 试剂 | KOH | NaOH | Ca(OH)2 |
| 价格(元/吨) | 6800 | 3200 | 1200 |

(15分)(1)取海水晒盐后的苦卤水作原料(其它合理答案给分,2分)
(2)Mg2++2OH-=Mg(OH)2↓或Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+(2分); ×10-6mol/L(2分,回答1.36×10-6mol/L也可);Ca(OH)2(1分);以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳(2分)
×10-6mol/L(2分,回答1.36×10-6mol/L也可);Ca(OH)2(1分);以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳(2分)
(3)方案一:不合理,H2、C或CO均不能还原MgO(2分)
方案二:不合理,MgO熔点高,能耗大,不经济(2分)
合理方案: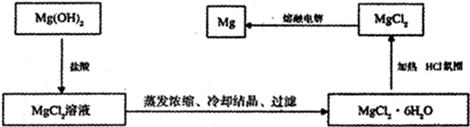 (2分)
(2分)
解析试题分析:(1)海水Mg2+中浓度很小,因此提高海水中Mg2+浓度的方法是取海水晒盐后的苦卤水作原料。
(2)步骤2的目的是将Mg2+转化为氢氧化镁沉淀,所以有关反应的离子方程式为Mg2++2OH-=Mg(OH)2↓或Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+;根据氢氧化镁的溶度积常数可知,浓缩海水中MgCI2浓度为3mo1/L,要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 =
= ×10-6mol/L;从经济效益和来源来看,最合理的沉淀剂应该是氢氧化钙。产生氢氧化钙的方法是以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳。
×10-6mol/L;从经济效益和来源来看,最合理的沉淀剂应该是氢氧化钙。产生氢氧化钙的方法是以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳。
(3)由于H2、C或CO均不能还原MgO所以方案一不合理;又因为MgO熔点高,能耗大,不经济,因此方案二也不合理;正确的方案应该是将氢氧化镁转化为氯化镁,然后电解熔融的氯化镁即可。流程图如下: 。
。
考点:考查海水中镁提纯的有关实验设计、分析、判断以及评价;溶度积常数的有关计算等


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学用废于电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验:
(1)上述三步操作中都用到的一种玻璃仪器是_____________________________。
(2)将灼烧后的固体移入试管,滴加双氧水,能迅速产生一种使带火星的木条复燃的气体,由此推断黑色固体中含有MnO2,其在反应中的作用为________,写出该反应的化学方程式_______________。MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式_____________________________________。
(3)验证步骤②的滤液中含有NH4+,下面是某一实验方案记录片断。请填写下列空白:
实验操作:_______________________________________________________________。
实验现象:有使湿润的红色石蕊试纸变蓝的气体产生。
实验结论:滤液中有NH4+存在。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液。为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A + B | 无明显现象 |
| ② | B + D | 有无色无味气体放出 |
| ③ | C + B | 有白色沉淀生成 |
| ④ | A + D | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中含有极为丰富的自然资源。很多常见的金属元素和非金属元素主要以简单离子的形式存在于海水中,海水呈弱碱性。回答下列问题:
海水提溴过程一般分三步,①向浓缩的海水中通入Cl2,将其中的Br-氧化,2Br-+Cl2=Br2+2Cl-,再用热空气吹出溴;②然后用饱和碳酸钠溶液吸收溴,溴歧化为NaBr、NaBrO3,③最后用硫酸酸化5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
(1)写出第②步反应的离子方程式 ;
(2)海水浓缩后还要进一步处理才能通入Cl2,处理的方法是 ,目的是 ,步骤③用硫酸而不用盐酸酸化的原因可能是 ;
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中 ;
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)海水制溴的原理体现了化学工业中“富集”“放大”思想。以海水为原料制备金属镁分三步,试写出其反应原理(用化学方程式表示)
, , 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
(1)装置③的作用是
装置①的作用是
(2)装置②中产生ClO2的还原剂是
装置④中制备ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品小打烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+.A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2~、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应韵化学方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下: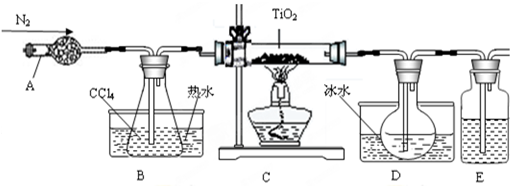
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com