
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:填空题
某学习小组欲模拟从某工厂废液中回收丙酮、乙醇和乙酸的实验。制定了如下试验流程。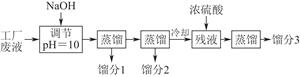
已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
含苯酚的工业废水处理的流程图如图所示:
(1)上述流程里,设备Ⅰ中进行的是_________操作(填写操作名称)。实验室里这一步
操作可以用____________(填写仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是_____ ____。由设备Ⅲ进入设备Ⅳ的物质B是______________。(均填写物质的化学式)
(3)在设备Ⅲ中发生反应的化学方程式为:_______ ________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________操作(填写操作名称),可以使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、________、__________。(均填写物质的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一固体混合物,可能由NaI、KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成;
③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成。
④往滤液中加入足量的新制的氯水,再加入少许汽油,振荡,静置,上层液体呈紫红色。
(1)试判断:固体混合物中肯定含有 ,
一定没有 ,
可能含有 。
(2)对可能含有的物质,如何进行实验以进一步检验。
。
(3)实验④中发生的化学反应属于 反应(填反应类型),主要实验操作名称叫 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳酸锂广泛应用于陶瓷和医药等领域,以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β—锂辉石要粉碎成细颗粒的目的是 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-;另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为 。
(5)从母液中可回收的主要物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是四种盐在不同温度下的溶解度(g/100g水):
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 ? 2H2O,工艺流程如下:
已知: ① 常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197; BaCl2 ? 2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式__________________________________
(2)高温下,SiCl4 (g) 用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收
59 kJ热量,则该反应的热化学方程式为__________________________________
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2 ②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2 ? 2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 ? 2H2O___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ;
生成滤渣1中红褐色物质的反应离子方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是: ;
洗涤时应选用 (选填字母)。
| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
| 试剂 | KOH | NaOH | Ca(OH)2 |
| 价格(元/吨) | 6800 | 3200 | 1200 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com