
分析 (1)利用太阳能分解,该反应中二氧化钛作催化剂,电解水是吸热反应;
(2)二氧化钛与焦炭的混合物中通入Cl2生成TiCl4和CO,据此书写方程式;
(3)总反应为正负反应相加,燃料电池的优点为利用率高,无污染.
解答 解:(1)科学家利用太阳能使海水分解,该反应中二氧化钛作催化剂;电解水是吸热反应,
故答案为:催化剂;吸热;
(2)二氧化钛与焦炭的混合物中通入Cl2生成TiCl4和CO,方程式为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,故答案为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
(3)总反应为正负反应相加,方程式为 O2+2H2═2H2O,燃料电池的优点为利用率高,无污染,故答案为:O2+2H2═2H2O,利用率高,无污染.
点评 本题考查原电池反应的原理以及燃料电池的优点,注意负极发生氧化反应,正极发生还原反应,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气光照条件下反应,反应类型为取代反应;乙烯可以使溴水褪色,发生加成反应 | |
| B. | 不能用酸性高锰酸钾溶液鉴别乙酸和乙醇 | |
| C. | 乙醇在铜做催化剂并加热条件下生成乙醛,发生催化氧化反应 | |
| D. | 生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选 项 | A | B | C | D |
| 物 质 | MgCl2 | CO2 | HCl | NaOH |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
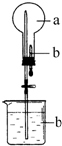 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | CH4、Cl2混合气和饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
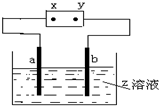 如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( ) | a极板 | b极板 | x电极 | Z溶液 | |
| A | 铜 | 银 | 负极 | CuCl2 |
| B | 石墨 | 石墨 | 正极 | NaOH |
| C | 铁 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 银 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 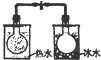 |
| 根据电流表(A)中指针是否偏转即可比较Zn,Cu的金属活泼性 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 | 根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com