
【题目】准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 滴定过程中,锥形瓶中水的电离程度先增大后减小
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的是
选项 | 实验目的 | 实验方案 |
A | 测定铝箔中氧化铝的含量 | 取 |
B | 比较醋酸与硼酸的酸性强弱 | 分别向 |
C | 验证 | 取滤纸条放入 |
D | 证明溶液中存在平衡: | 向盛有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g) + N2(g) ![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq) + FeCl3(aq)![]() Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B. ①④ C. ②④ D. 无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质及其化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(1)推断各符号所代表的物质的化学式:
A____,B___,C____,D____,E____。
(2)分别写出反应②、④、⑤的化学方程式:
②_____,
④_____,
⑤_____。
(3)写出反应③的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸(H2MA,Ka1=1.4×10-3;Ka2=1.7×10-5)是一种安全的食品保鲜剂,H2MA分子比离子更易透过细胞膜而杀灭细菌。常温下,向20 mL 0.2 mol/L H2MA溶液中滴加0.2mol/L NaOH溶液。根据图示判断,下列说法正确的是

A. b点比a点杀菌能力强
B. 曲线Ⅲ代表HMA-物质的量的变化
C. MA2-水解常数Kh≈7.14×10-12
D. 当V=30 mL时,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
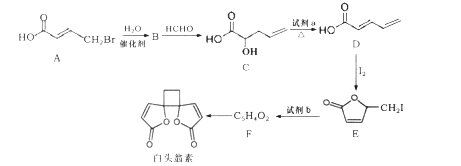
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
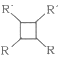
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成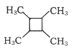 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题。
(1)实验室中少量的钠通常保存在____中,在实验室中取用钠的仪器是_____。
(2)将金属钠投入水中,发生反应的离子方程式为______________________。
(3)该同学在实验室欲配制500mL 0.1mol/L NaOH溶液。
①配制溶液时肯定不需要如下图所示仪器中的_____________(填字母),配制上述溶液还需要用到的玻璃仪器是_____________(填仪器名称)。

②配制溶液时有如下操作:a.溶解 b.摇匀 c.洗涤 d.冷却 e.称量 f.将溶液移至容量瓶g.定容,实验操作顺序正确的是________。
a. e→a→f→d→c→f→g→b b. e→a→d→f→c→f→g→b
c. e→a→f→d→c→f→b→g d. e→a→d→f→c→f→b→g
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L。下列操作会引起所配浓度偏大的是______。
a.烧杯未进行洗涤
b.配制前,容量瓶中有少量蒸馏水
c.往容量瓶转移时,有少量液体溅出
d.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
e.在容量瓶中定容时俯视容量瓶刻度线
f.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
④为中和100mL 2.3 mol·L-1 稀硫酸后显中性,需要加入______L 0.1mol/L NaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:

下列说法不正确的是
A. 装置②中试剂可以是NaOH溶液
B. 装置③的作用是干燥O2
C. 收集氧气应选择装置a
D. 装置②、③之间应增加盛澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作____极(填“阴”或“阳”)。
(2)硒在元素周期表中的位置如图所示:

Se原子结构示意图可表示为________。
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族________。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式________。
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为_______。
③ 写出步骤ⅱ中的化学方程式_______。
(4)下列说法合理的是________。
a. SeO2既有氧化性又有还原性,其还原性比SO2强
b. 浓硒酸可能具有强氧化性、脱水性
c. 热稳定性:H2Se < HCl < H2S
d. 酸性:H2SeO4 < HBrO4 < HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com