
【题目】A、B、C、D、E五种物质是含钠元素的单质及其化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(1)推断各符号所代表的物质的化学式:
A____,B___,C____,D____,E____。
(2)分别写出反应②、④、⑤的化学方程式:
②_____,
④_____,
⑤_____。
(3)写出反应③的离子方程式___。
【答案】Na(或Na2O) Na2O2 NaOH Na2CO3 NaHCO3 2Na+2H2O=2NaOH+H2↑(或Na2O+H2O=2NaOH) 2Na2O2+2CO2=2Na2CO3+O2 CO2+H2O+Na2CO3=2NaHCO3 CO2+2OH-=CO32-+H2O
【解析】
A,B,C,D,E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,所以B为Na2O2;
Na2O2与CO2反应生成Na2CO3和O2,则D为Na2CO3;
Na2CO3与CO2和H2O反应生成的E为NaHCO3;
NaHCO3与C反应生成Na2CO3,且Na2O2与H2O反应也生成C,则C为NaOH;
A与H2O生成NaOH,A也能生成Na2O2,则A为Na(或Na2O),据此结合问题解答。
(1)由以上分析,各符号所代表的物质的化学式:A为Na(或Na2O),B为Na2O2,C为NaOH,D为Na2CO3,E 为NaHCO3;
(2)②为Na(或Na2O)与水反应生成氢氧化钠和氢气(或Na2O与水反应生成氢氧化钠),化学方程式为:2Na+2H2O=2NaOH+H2↑(或Na2O+H2O=2NaOH);
④为过氧化钠与二氧化碳反应生成碳酸钠和氧气的过程,其化学方程式为:2Na2O2+2CO2=2Na2CO3+O2
⑤为Na2CO3与CO2和H2O反生成NaHCO3,其化学方程式为:CO2+H2O+Na2CO3=2NaHCO3;
(3)反应③为氢氧化钠与CO2反应生成碳酸钠和水,其离子方程式为:CO2+2OH-=CO32-+H2O。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于价电子排布式为3s23p4的粒子的描述正确的是( )
A. 它的原子核外有三种形状不同的电子云
B. 它的原子核外电子共有16种不同的运动状态
C. 它可与H2反应生成常温时的液态化合物
D. 该原子的轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“电池的正极采用含有![]() 的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用
的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用![]() 溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含
溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含![]() 的溶液呈棕黄色,下列有关判断正确的是
的溶液呈棕黄色,下列有关判断正确的是
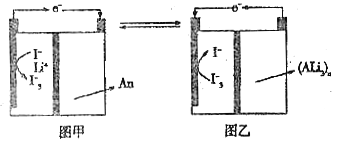
A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 放电时,![]() 从右向左通过聚合物离子交换膜
从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种鉴别碳酸钠和碳酸氢钠的方法是否可行?按要求回答下列问题。
(1)将两种试样分别溶于水配成浓度相同的溶液,分别滴入数滴酚酞是否可以鉴别____(可行,不可行),若可行请写出实验现象及结论__。
(2)将两个固体配制成为稀溶液,滴加氯化钙是否可以鉴别___(可行,不可行),若可行请写出实验现象及结论(用离子方程式并结合文字说明)___。
(3)2支试管中分别放入约1g 的两种试样并配成10毫升溶液,同时滴加等量的稀盐酸是否可以鉴别___(可行,不可行),若可行请写出实验现象及结论___。
(4)2支试管中分别放入约1g 的两种试样并配成10毫升溶液,分别滴加足量的氢氧化钙溶液是否可以鉴别___(可行,不可行),原因(用文字说明)___。
(5)取等质量两种固体,利用如图装置进行鉴别,试管A中装入的固体是___(填化学式),试管B中装入的固体是___(填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 滴定过程中,锥形瓶中水的电离程度先增大后减小
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.从1L1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5L2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D.10g98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1,6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6mol。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1,6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6mol。

(1)a点正反应速率____(填“大于”“等于”或“小于”)逆反应速率。
(2)下列时间段平均反应速率最大的是____。
A.0~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线)。曲线Ⅰ对应的实验条件改变是____,曲线Ⅱ对应的实验条件改变是______,体积不变再充入3 mol CO2和4 mol H2,达到新的平衡时,H2O(g)的体积分数____(填“增大”“不变”或“减小”)。
(4)若将1 mol CO2和3 mol H2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______(用a表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com