
【题目】下列关于价电子排布式为3s23p4的粒子的描述正确的是( )
A. 它的原子核外有三种形状不同的电子云
B. 它的原子核外电子共有16种不同的运动状态
C. 它可与H2反应生成常温时的液态化合物
D. 该原子的轨道表示式为![]()
【答案】B
【解析】
A. 电子云的形状种数由该原子能级种类确定;
B. 原子核外电子运动状态和该原子的核外电子数相等;
C. 硫与氢气反应生成硫化氢,在常温下,硫化氢为气体;
D. 3p能级上电子排布图违反洪特规则。
A. 价电子构型为3s23p4的元素是16号元素S,具有s和p两种能级,因此该原子的电子云形状有两种,分别是球形和哑铃形,故A项错误;
B. S原子具有16个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有16种不同的运动状态,故B项正确;
C. 硫和氢气化合生成的硫化氢在常温下是气体而不是液体,故C项错误;
D. 电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以3p能级上电子排布图违反洪特规则,故D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】将 CO2 在一定条件下与 H2 反应转化为甲醇(CH3OH)是变废为宝的好办法,一定条件下,每转化 44 kg CO2 放出的热量为 49000 kJ,CO2 转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是

A. 0~3 min 内,用 CO2 和 H2 来表达的平均反应速率相等,均为 0.5 mol/(L·min)
B. 此反应的热化学方程式为 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H = - 49 kJ/mol
C. 此条件下反应的平衡常数K=0.753×1.25/(0.75×0.75)
D. 降低温度,此反应的平衡常数可能为 0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学仿照“喷泉”实验的原理,在实验室做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可以看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO气体中的两种,则下列判断中正确的是( )

A.X是NH3,Y是HCl
B.X是Cl2,Y是NH3
C.X是SO2,Y是O2
D.X是NO,Y是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
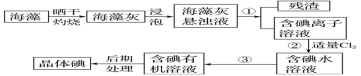
(1)实验室灼烧海带,需要下列仪器中的___(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f. 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:
①____,③____。
(3)提取碘的过程中,可选择的有机试剂是___。
A.苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、酒精
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有___、__。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
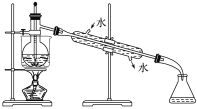
①_____;
②_____;
③_____。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生话密切相关。下列说法错误的是
A. 生活中用到的陶瓷,如日用器皿、建筑饰材、卫生活具等主要是传统硅酸盐陶瓷
B. 铝制餐具不宜用来蒸煮或长时间存放酸性和碱性食物,但可长时间存放咸的食物
C. 洗发时使用的护发素主要是调节头发的![]() ,使之达到适宜的酸碱度
,使之达到适宜的酸碱度
D. 煤的干馏、海带提碘、石油裂解、芒硝风化等都涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的是
选项 | 实验目的 | 实验方案 |
A | 测定铝箔中氧化铝的含量 | 取 |
B | 比较醋酸与硼酸的酸性强弱 | 分别向 |
C | 验证 | 取滤纸条放入 |
D | 证明溶液中存在平衡: | 向盛有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
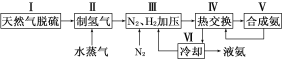
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________。
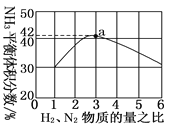
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质及其化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(1)推断各符号所代表的物质的化学式:
A____,B___,C____,D____,E____。
(2)分别写出反应②、④、⑤的化学方程式:
②_____,
④_____,
⑤_____。
(3)写出反应③的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com