
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
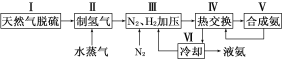
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________。
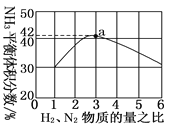
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________。
【答案】2NH4HS+O2![]() 2NH3·H2O+2S↓ a 90% 14.5%
2NH3·H2O+2S↓ a 90% 14.5%
【解析】
(1)根据氧化还原反应的规律,进行方程式的配平,NH4HS中-2价的S元素被氧气氧化成S单质,NH4+最终以NH3·H2O形式存在;
(2)根据反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1可知,该反应正反应为吸热反应,若提高平衡体系中H2百分含量,需使平衡向正反应方向移动,又能加快反应速率,不能降低压强或减少反应物的浓度,综合影响化学反应速率与化学平衡的各因素分析作答;设CO的转化量为x,列出反应的“三段式”得出其转化率;
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1可知,该反应正反应为吸热反应,若提高平衡体系中H2百分含量,需使平衡向正反应方向移动,又能加快反应速率,不能降低压强或减少反应物的浓度,综合影响化学反应速率与化学平衡的各因素分析作答;设CO的转化量为x,列出反应的“三段式”得出其转化率;
(3)根据图1可知H2与N2的投料比为3,平衡时NH3体积分数为42%,设H2物质的量为3a mol,N2物质的量为a mol,N2转化的物质的量为x,列出反应的“三段式”得出N2的平衡物质的量分数,因相同条件下,气体的体积之比等于气体的物质的量之比,得出结论。
(1)通入空气后,O2把NH4HS 氧化为S,可得化学方程式:2NH4HS+O2![]() 2NH3·H2O+2S↓,
2NH3·H2O+2S↓,
故答案为:2NH4HS+O2![]() 2NH3·H2O+2S↓;
2NH3·H2O+2S↓;
(2)a. 反应①为吸热反应,升高温度,化学反应速率加快,同时平衡向右移动,使H2的百分含量增大,符合题意,故a正确;
b. 增大水蒸气浓度,平衡虽向右移动,但H2的百分含量会减小,故b错误;
c. 加入催化剂,能加快反应速率,但平衡不移动,则H2的百分含量不变,故c错误;
d. 降低压强,平衡虽向右移动,但反应速率减小,故d错误;
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始量(mol) 0.2 0 0.8
转化量(mol) x x x
剩余量(mol) 0.2-x x 0.8+x
(0.2-x)+x+(0.8+x)=1.18 mol,则x = 0.18 mol,可得CO转化率 = ![]() ×100% = 90%;
×100% = 90%;
(3)根据图1可知H2与N2的投料比为3,平衡时NH3体积分数为42%,设H2物质的量为3a mol,N2物质的量为a mol,N2转化的物质的量为x,则
N2 + 3H2 ![]() 2NH3
2NH3
初始量(mol) a 3a 0
转化量(mol) x 3x 2x
剩余量(mol)a-x 3a-3x 2x
则![]() ÷×100% = 42%,解得x = 0.592 a,则N2的平衡体积分数 =
÷×100% = 42%,解得x = 0.592 a,则N2的平衡体积分数 =![]() ×100% = 14.5%。
×100% = 14.5%。


科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子排布式为3s23p4的粒子的描述正确的是( )
A. 它的原子核外有三种形状不同的电子云
B. 它的原子核外电子共有16种不同的运动状态
C. 它可与H2反应生成常温时的液态化合物
D. 该原子的轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:(图中F2)根据各图表示的结构特点,下列有关叙述正确的是( )

A. 上述结构图中共出现6种元素 B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物 D. 向CaCl2溶液中通入丙有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短同期主族元素![]() 原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的
原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的![]() 水溶液
水溶液![]() 如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
| 甲 | 乙 | 丙 | 丁 |
| 13 | 11 | 5 | 1 |
A. 原子半径:![]() B. 配制丙溶液时需加入丁溶液
B. 配制丙溶液时需加入丁溶液
C. 乙溶液去油污时只涉及到盐类的水解D. 海水提镁的过程中一定用到化合物甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸
B. 无机含氧酸分子中含有几个羟基,它就属于几元酸
C. 同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D. H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“电池的正极采用含有![]() 的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用
的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用![]() 溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含
溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含![]() 的溶液呈棕黄色,下列有关判断正确的是
的溶液呈棕黄色,下列有关判断正确的是
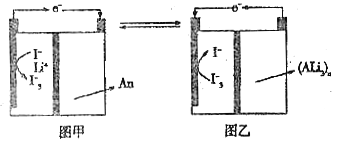
A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 放电时,![]() 从右向左通过聚合物离子交换膜
从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种鉴别碳酸钠和碳酸氢钠的方法是否可行?按要求回答下列问题。
(1)将两种试样分别溶于水配成浓度相同的溶液,分别滴入数滴酚酞是否可以鉴别____(可行,不可行),若可行请写出实验现象及结论__。
(2)将两个固体配制成为稀溶液,滴加氯化钙是否可以鉴别___(可行,不可行),若可行请写出实验现象及结论(用离子方程式并结合文字说明)___。
(3)2支试管中分别放入约1g 的两种试样并配成10毫升溶液,同时滴加等量的稀盐酸是否可以鉴别___(可行,不可行),若可行请写出实验现象及结论___。
(4)2支试管中分别放入约1g 的两种试样并配成10毫升溶液,分别滴加足量的氢氧化钙溶液是否可以鉴别___(可行,不可行),原因(用文字说明)___。
(5)取等质量两种固体,利用如图装置进行鉴别,试管A中装入的固体是___(填化学式),试管B中装入的固体是___(填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.从1L1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5L2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D.10g98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com