
【题目】短同期主族元素![]() 原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的
原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的![]() 水溶液
水溶液![]() 如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
| 甲 | 乙 | 丙 | 丁 |
| 13 | 11 | 5 | 1 |
A. 原子半径:![]() B. 配制丙溶液时需加入丁溶液
B. 配制丙溶液时需加入丁溶液
C. 乙溶液去油污时只涉及到盐类的水解D. 海水提镁的过程中一定用到化合物甲
【答案】B
【解析】
0.1mo/L甲溶液的pH=13,说明甲溶液为强碱溶液,短周期元素形成的强碱为NaOH,则甲为NaOH;0.1mol/L的丁溶液的pH=1,应为氢化物,且完全电离,则丁为HCl;0.1mol/L的乙、丙溶液的pH分别为11、5,则乙为弱碱性溶液,丙为弱酸性溶液;甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失,说明丙溶液中含有铝离子,为AlCl3;乙的水溶液可除油污,可能为Na2CO3,结合短周期主族元素X、Y、Z、W、R、Q原子序数依次增大可知:X、Y、Z、W、R、Q分别为H、C、O、Na、Al、Cl,据此解答。
根据分析可知,X、Y、Z、W、R、Q分别为H、C、O、Na、Al、Cl,
A. 同周期元素从左到右原子半径依次减小,同主族元素从上到下原子半径依次增大,则原子半径:![]() ,A项错误;
,A项错误;
B. 丙溶液为氯化铝溶液,配制时为抑制其水解需加入HCl,B项正确;
C. Na2CO3可以去油污是由于Na2CO3溶于水后水解显碱性,油脂在碱性条件下水解生成对应的醇与酸钠而溶解,C项错误;
D. 海水提镁的过程中没有用氢氧化钠,而用石灰乳来沉淀镁元素,D项错误;
答案选B。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】薄荷醇的结构简式如图所示。下列说法错误的是

A. 薄荷醇分子式为C10H20O,是己醇的同系物
B. 薄荷醇能使酸性高锰酸钾溶液褪色
C. 一氯薄荷醇共有9种(不含立体异构)
D. 薄荷醇与金属钠的反应比水与金属钠的反应平缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生话密切相关。下列说法错误的是
A. 生活中用到的陶瓷,如日用器皿、建筑饰材、卫生活具等主要是传统硅酸盐陶瓷
B. 铝制餐具不宜用来蒸煮或长时间存放酸性和碱性食物,但可长时间存放咸的食物
C. 洗发时使用的护发素主要是调节头发的![]() ,使之达到适宜的酸碱度
,使之达到适宜的酸碱度
D. 煤的干馏、海带提碘、石油裂解、芒硝风化等都涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的是
选项 | 实验目的 | 实验方案 |
A | 测定铝箔中氧化铝的含量 | 取 |
B | 比较醋酸与硼酸的酸性强弱 | 分别向 |
C | 验证 | 取滤纸条放入 |
D | 证明溶液中存在平衡: | 向盛有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体型分子且键角都为109.5°
C. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
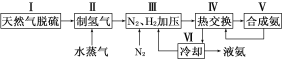
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________。
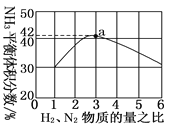
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅡBⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。回答下列问题:
(1)基态锌(Zn)原子的电子排布式为[Ar]_____。
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是______(填标号)
a 构造原理 b 泡利原理 c 洪特规则 d 能量最低原理
(3)在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______。
(4)H2O2和H2S的相对分子质量相等,常温下,H2O2呈液态,而H2S呈气态,其主要原因是______;![]() 的中心原子杂化类型为_______,其空间构型为_______。
的中心原子杂化类型为_______,其空间构型为_______。
(5)ZnO具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知锌元素、氧元素的电负性分别为1.65、3.5,ZnO中化学键的类型为______。ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,请从化学键角度解释能够形成该离子的原因。_______。

②一种ZnO晶体的晶胞如图所示。晶胞边长为a nm、阿伏加德罗常数的值为NA,其晶体密度为________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g) + N2(g) ![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq) + FeCl3(aq)![]() Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B. ①④ C. ②④ D. 无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题。
(1)实验室中少量的钠通常保存在____中,在实验室中取用钠的仪器是_____。
(2)将金属钠投入水中,发生反应的离子方程式为______________________。
(3)该同学在实验室欲配制500mL 0.1mol/L NaOH溶液。
①配制溶液时肯定不需要如下图所示仪器中的_____________(填字母),配制上述溶液还需要用到的玻璃仪器是_____________(填仪器名称)。

②配制溶液时有如下操作:a.溶解 b.摇匀 c.洗涤 d.冷却 e.称量 f.将溶液移至容量瓶g.定容,实验操作顺序正确的是________。
a. e→a→f→d→c→f→g→b b. e→a→d→f→c→f→g→b
c. e→a→f→d→c→f→b→g d. e→a→d→f→c→f→b→g
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L。下列操作会引起所配浓度偏大的是______。
a.烧杯未进行洗涤
b.配制前,容量瓶中有少量蒸馏水
c.往容量瓶转移时,有少量液体溅出
d.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
e.在容量瓶中定容时俯视容量瓶刻度线
f.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
④为中和100mL 2.3 mol·L-1 稀硫酸后显中性,需要加入______L 0.1mol/L NaOH溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com