
【题目】ⅡBⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。回答下列问题:
(1)基态锌(Zn)原子的电子排布式为[Ar]_____。
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是______(填标号)
a 构造原理 b 泡利原理 c 洪特规则 d 能量最低原理
(3)在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______。
(4)H2O2和H2S的相对分子质量相等,常温下,H2O2呈液态,而H2S呈气态,其主要原因是______;![]() 的中心原子杂化类型为_______,其空间构型为_______。
的中心原子杂化类型为_______,其空间构型为_______。
(5)ZnO具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知锌元素、氧元素的电负性分别为1.65、3.5,ZnO中化学键的类型为______。ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,请从化学键角度解释能够形成该离子的原因。_______。

②一种ZnO晶体的晶胞如图所示。晶胞边长为a nm、阿伏加德罗常数的值为NA,其晶体密度为________g·cm3。
【答案】3d104s2 b Br>As>Se>Te H2O2分子间存在氢键 sp3杂化 三角锥形 离子键 Zn2+可以通过配位键与OH—结合成为络离子 3.24×1023/(a 3NA)
【解析】
(1)锌为30号元素,据此书写基态锌(Zn)原子的电子排布式;
(2)根据“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,结合各选项分析判断;
(3) 同周期元素,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;同族元素,从上至下第一电离能逐渐减小,据此判断Te、As、Se、Br的第一电离能的大小顺序;
(4) H2O2分子间存在氢键,而H2S分子间不能形成氢键;根据价层电子对数=σ键个数+孤电子对个数分析解答;
(5)①根据电负性的差值>1.7,形成离子键,<1.7形成共价键判断;根据[Zn(OH)4]2—中存在配位键分析解答;②根据均摊法计算ZnO晶胞中含有的Zn、O原子数,计算晶胞的质量,再计算晶胞的密度。
(1)锌为30号元素,基态锌(Zn)原子的价电子排布式为 3d104s2,故答案为:3d104s2;
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是泡利原理,故答案为:b;
(3) 同周期元素,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;同族元素,从上至下第一电离能逐渐减小。在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻,则Te、As、Se、Br的第一电离能由大到小排序为Br>As>Se>Te,故答案为:Br>As>Se>Te;
(4)H2O2和H2S的相对分子质量相等,但H2O2分子间存在氢键,沸点较高,H2S分子间不能形成氢键,使得常温下,H2O2呈液态,而H2S呈气态;![]() 的中心原子Se的价层电子对数=3+
的中心原子Se的价层电子对数=3+![]() =4,采用sp3杂化,其空间构型为三角锥形,故答案为:H2O2分子间存在氢键;sp3杂化;三角锥形;
=4,采用sp3杂化,其空间构型为三角锥形,故答案为:H2O2分子间存在氢键;sp3杂化;三角锥形;
(5)①锌元素、氧元素的电负性分别为1.65、3.5,ZnO中电负性的差值=3.5-1.65=1.85>1.7,构成离子键;Zn2+可以通过配位键与OH—结合成为络离子,导致ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,故答案为:离子键;Zn2+可以通过配位键与OH—结合成为络离子;
②ZnO晶胞中含有Zn原子数=8×![]() +6×
+6×![]() =4,O原子数=12×
=4,O原子数=12×![]() +1=4,因此晶胞的质量=
+1=4,因此晶胞的质量=![]() g,晶胞的体积=(a×10-7)3cm3,晶胞的密度=
g,晶胞的体积=(a×10-7)3cm3,晶胞的密度=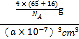 =
=![]() ×1023 g·cm3,故答案为:
×1023 g·cm3,故答案为:![]() ×1023。
×1023。


科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,保持一定条件下进行以下反应:A(g)+2B(g)![]() xC(g),已知加入1 mol A和3 mol B。达到平衡后,生成a mol C。
xC(g),已知加入1 mol A和3 mol B。达到平衡后,生成a mol C。
(1)若x=2,在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到平衡后,生成C的物质的量为_______。
A.n(C)= a mol B.a mol<n(C)<2a mol C.n(C)=2a mol D.n(C)>2a mol
(2)若x =2,在相同实验条件下,若在同一容器中改为加入m mol A、n mol B、p mol C若要求达平衡后反应混合气体中C体积分数保持不变,则m、n的关系为______________。
(3)若x =3,在相同实验条件下,若在同一容器中改为加入0.5 mol A,则需加入_____mol B,_____mol C,才能使平衡时C为0.9 a mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液溶质质量分数为
A. 12.5%B. >12.5%C. <12.5%D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短同期主族元素![]() 原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的
原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的![]() 水溶液
水溶液![]() 如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
| 甲 | 乙 | 丙 | 丁 |
| 13 | 11 | 5 | 1 |
A. 原子半径:![]() B. 配制丙溶液时需加入丁溶液
B. 配制丙溶液时需加入丁溶液
C. 乙溶液去油污时只涉及到盐类的水解D. 海水提镁的过程中一定用到化合物甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
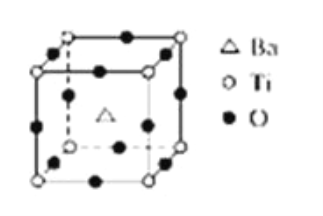
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“电池的正极采用含有![]() 的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用
的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用![]() 溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含
溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含![]() 的溶液呈棕黄色,下列有关判断正确的是
的溶液呈棕黄色,下列有关判断正确的是
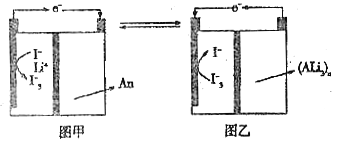
A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 放电时,![]() 从右向左通过聚合物离子交换膜
从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)++3CO2 (g)的△H=______kJ/mol
Ⅱ.—定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2 L的密闭容器按甲、乙两种方式投入反应物发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)

甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内平均反应速率_______,此条件下该反应的平衡常数K= ____。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是: y____z(填或“>”“<”“ = ”),且y=_________(用含的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3 (g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:
C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:

则△H_____(填“>”、“<”或“ = ”),压强p1、p2、p3从大到小的顺序是_____。
(3)CO可被NO2氧化:CO+NO2 =CO2+ NO。当温度高于225℃时,反应速率![]() 正=k正 c(CO) c(NO2),
正=k正 c(CO) c(NO2), ![]() 逆=k逆 c(CO2) c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为___________。
逆=k逆 c(CO2) c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究表明As2O3在医药领域有重要应用。某小组从工业废料中提取As2O3设计流程如下:

已知:H3AsO3为弱酸,热稳定性差。
(1)写出一条“碱浸”时提高浸取率的方法____;“碱浸”中H3AsO3转化成Na3AsO3的离子方程式为____。
(2)“氧化”时常在向混合液中通入O2时对体系加压,目的是____。
(3)“沉砷”过程中有如下反应:
①![]()
![]() <0
<0
②![]()
![]() >0
>0
沉砷率与温度关系如图。沉砷最佳温度为____,高于85℃时,沉砷率下降的原因是____。

(4)“还原”过程中获得H3 AsO3的化学反应方程式为____;“操作A”为:____、过滤;滤液Ⅱ的主要成分是____。
(5)若每步均完全反应,“氧化’’和“还原”时消耗相同条件下O2和SO2体积分别为xL、yL,则废水中n(H3AsO3):n(H3AsO4)=____(写出含x、y的计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com