
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。

【答案】[Ar]3d5或1s22s23p63s23p63d5 O>N>C>H sp2杂化 平面三角形 分子 ABD 减少 NA(或6.02![]() 10-23)
10-23) ![]()
![]()
【解析】
(1)Fe为26号元素,基态Fe的电子排布式为1s22s22p63s23p63d64s2,失去3个电子生成Fe3+,则Fe3+的核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5;Fe(H2NCONH2)6](NO3)3中所含非金属元素为H、C、N、O,通常元素的非金属性越强,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;Fe(H2NCONH2)6](NO3)3中尿素分子的结构简式为![]() ,C原子形成3个σ键,无孤对电子,所以是sp2杂化;NO3-中N的价层电子对数是3,且不存在孤对电子,所以NO3-的空间构型为平面三角形。答案:[Ar]3d5或1s22s22p63s23p63d65;O>N>C>H、sp2、平面三角形。
,C原子形成3个σ键,无孤对电子,所以是sp2杂化;NO3-中N的价层电子对数是3,且不存在孤对电子,所以NO3-的空间构型为平面三角形。答案:[Ar]3d5或1s22s22p63s23p63d65;O>N>C>H、sp2、平面三角形。
(2)卤素单质属于分子晶体,铝原子簇A113的性质与卤素相似,则原子簇A113也属于分子晶体。Na[Al(OH)4]属于离化合物,存在着离子键,铝是缺电子结构,能接受氢氧根离子给与的孤对电子形成配位键,氧氢之间可以形成极性键。所以Na[Al(OH)4]属于离化合物中含有离子键、极性键、配位键。答案:分子,ABD。
(3)每生成1mol氯吡苯脲,需要1mol2-氯-4-氨基吡啶、1mol异氰酸苯酯,反应过程中每个2-氯-4-氨基吡啶分子断裂一个σ键、每个异氰酸苯酯分子断裂一个π键,所以当σ键增加了1 mol时,π键减少了NA(或6.02![]() 10-23)个。答案:减少;NA(或6.02
10-23)个。答案:减少;NA(或6.02![]() 10-23)。
10-23)。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。因为![]() (咪唑)中的有5个原子参与形成π键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为
(咪唑)中的有5个原子参与形成π键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为![]() ;答案:
;答案:![]() 。
。
(5)晶胞结构分析可知一个晶胞中含铁原子8×1/8+6×1/2=4,碳原子12×1/4+1=4,化学式中铁原子和碳原子比为1:1,化学式为FeC;晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则2a2=x2,a=![]() ,密度d=m/V=
,密度d=m/V=![]() ,解得x=
,解得x=![]() cm=
cm=![]() pm。答案:
pm。答案:![]() 。
。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. B的物质的量浓度 B. 混合气体的密度
C. 混合气体的压强 D. v(B消耗)=3v(D消耗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 CO2 在一定条件下与 H2 反应转化为甲醇(CH3OH)是变废为宝的好办法,一定条件下,每转化 44 kg CO2 放出的热量为 49000 kJ,CO2 转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是

A. 0~3 min 内,用 CO2 和 H2 来表达的平均反应速率相等,均为 0.5 mol/(L·min)
B. 此反应的热化学方程式为 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H = - 49 kJ/mol
C. 此条件下反应的平衡常数K=0.753×1.25/(0.75×0.75)
D. 降低温度,此反应的平衡常数可能为 0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 20 L 的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,发生:CO(g)+2H2(g)CH3OH(g) ΔH。测得 CO 的转化率随温度的变化及不同压强下的变化,p2 和 195 ℃时 n(H2)随时间的变化结果如图表所示。下列说法正确的是( )

A. 0~3 min,平均速率 v(CH3OH)=0.8 mol·L-1·min-1
B. p1<p2,ΔH>0
C. 在 B 点时,v 正>v 逆
D. 在 p2 及 195 ℃时,该反应的平衡常数为 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷醇的结构简式如图所示。下列说法错误的是

A. 薄荷醇分子式为C10H20O,是己醇的同系物
B. 薄荷醇能使酸性高锰酸钾溶液褪色
C. 一氯薄荷醇共有9种(不含立体异构)
D. 薄荷醇与金属钠的反应比水与金属钠的反应平缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2KClO3 + H2C2O4 + H2SO4= K2SO4 + 2ClO2 + 2CO2 + 2H2O。
(1)用单线桥法表示该反应的电子转移的方向和数目_______。
(2)该反应的氧化剂是____,还原剂是_____,氧化产物是_____,还原产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学仿照“喷泉”实验的原理,在实验室做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可以看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO气体中的两种,则下列判断中正确的是( )

A.X是NH3,Y是HCl
B.X是Cl2,Y是NH3
C.X是SO2,Y是O2
D.X是NO,Y是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
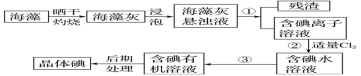
(1)实验室灼烧海带,需要下列仪器中的___(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f. 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:
①____,③____。
(3)提取碘的过程中,可选择的有机试剂是___。
A.苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、酒精
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有___、__。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
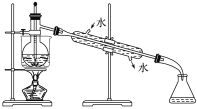
①_____;
②_____;
③_____。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
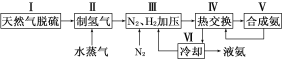
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________。
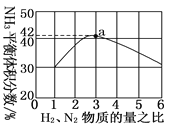
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com