
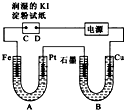
 电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
| ||
| ||
| 1 |
| 3 |
| 0.0056L |
| 22.4L/mol |
| 0.001mol |
| 1L |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
 石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则如图中7个六元环完全占有的碳原子数是( )
石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则如图中7个六元环完全占有的碳原子数是( )| A、10个 | B、14个 |
| C、18个 | D、21个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若V1=V2,且溶液的pH>7,则一定有c1<c2 |
| B、若混合液的pH=7,则一定有c1v1>c2v2 |
| C、若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
| D、若c1V1=c2V2,则混合溶液中有c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(M+)>c(A-)>c( OH-)>c(H+) |
| B、c(M+)>c(A-)>c(H+)>c( OH-) |
| C、c(M+)>c( OH-)>c(A-)>c(H+) |
| D、c(M+)>c(H+)=c( OH-)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑥ | B、②③⑥ |
| C、③④⑤ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将烧碱逐滴加入醋酸溶液中至溶液呈中性,则该混合液中还有少量醋酸未被中和 |
| B、将0.1 mol?L-1 CH3COOH溶液加水稀释,在此过程中,醋酸的电离程度、H+浓度都逐渐增大 |
| C、将醋酸逐滴加入醋酸钠溶液中至溶液呈酸性,则该溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、常温下,将pH=12的烧碱溶液与pH=2的醋酸溶液等体积混合,所得混合液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH值:②>③>① |
| B、水电离出的c(OH-):③>①>② |
| C、①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.05mol/L |
| D、室温,碳酸钙在①中的ksp比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
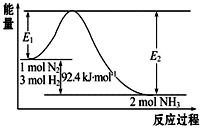 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com