
【题目】下列将CH3CHO和CH3COOH分离的正确方法是( )
A.蒸馏
B.加入Na2CO3溶液后,通过萃取的方法分离
C.加入烧碱溶液后蒸馏出乙醛,再加入浓硫酸,蒸馏出乙酸
D.和Na反应后进行分离
科目:高中化学 来源: 题型:
【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将相应的字母序号填入表中的顺序为:
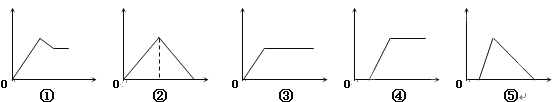
溶 液 | 加入物质 | 答案序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠的溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
A.①③②④⑤ B. ③⑤④②① C. ①②③④⑤ D. ③②④⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0 1mol·L-1、体积分别为V a和Vb的HA 溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是

A. a→c过程中水的电离程度始终增大
B. b点时,c(B+)=c(A+)=c(H+)=c(OH-)
C. c 点时, 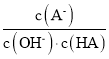 随温度升高而减小
随温度升高而减小
D. 相同温度下,Ka (HA)>Kb(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?_______________________________________ 。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
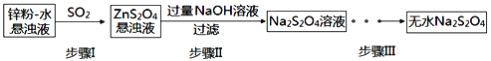
①步骤I中SO2表现了____________(填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________.
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:_________________
____HCOONa+____SO2+___Na2CO3===____Na2S2O4↓+___H2O+_________
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3 或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。 ____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
物质性质 | 实际应用 | |
A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B | 元素硅处于金属与非金属分界线 | 单质硅常用作光导纤维 |
C | 常温下,钠钾合金熔点低且导热性好 | 原子反应堆导热剂 |
D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列反应不能制得括号中的纯净物质的是 ( )
A. 乙烯与氯气加成(1,2-二氯乙烷) B. 乙烯与水加成(乙醇)
C. 等物质的量的氯气与乙烷在光照的条件下反应(氯乙烷) D. 氯气与苯用氯化铁作催化剂反应(氯苯)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.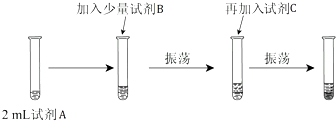
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)H2(g)+I2(g),2s时生成0.1mol H2 , 则以HI表示该时段的化学反应速率是( )
A.0.05 molLˉ1sˉ1
B.0.1 molLˉ1sˉ1
C.0.2 molLˉ1sˉ1
D.0.8 molLˉ1sˉ1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com