
实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如图所示方案:(注:碳酸氢铵受热可完全分解成气态物质)
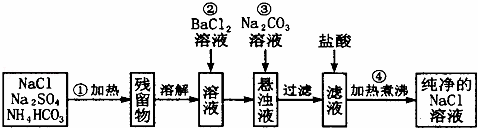
如果此方案正确,那么:
(1)操作①可选择的仪器是 坩埚 .
(2)操作②是否可改为加硝酸钡溶液?为什么? 不能 ;理由 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3﹣,以后操作中无法除去 .
(3)进行操作②后,如何判断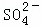 已除尽,方法是 取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42﹣已除尽 .
已除尽,方法是 取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42﹣已除尽 .
(4)操作③的目的是 除去过量的Ba2+ .
(5)操作④的目的是 除去滤液中溶解的CO2和多余的盐酸 .
| 粗盐提纯.. | |
| 专题: | 离子反应专题. |
| 分析: | (1)操作①将固体混合物加热,根据给固体加热常用仪器进行选择; (2)除杂不能引入新的杂质; (3)加入氯化钡溶液检验硫酸根离子是否除尽; (4)加入碳酸钠溶液,除去过量的氯化钡互溶钙离子;过滤后加碳酸钠溶液会增加了过滤操作次数; (5)盐酸和二氧化碳在加热煮沸的情况下可以挥发出来,不影响氯化钠的纯度. |
| 解答: | 解:(1)根据图示,操作①是将固体混合物加热,使用到的仪器是坩埚;故答案为:坩埚; (2)加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质; 故答案为:不能; 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3﹣,以后操作中无法除去; (3)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽; 故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42﹣已除尽; (4)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤; 故答案为:除去过量的Ba2+; (5)操作④加热煮沸溶液的目的是除去滤液中溶解的CO2和多余的盐酸;故答案为:除去滤液中溶解的CO2和多余的盐酸. |
| 点评: | 本题考查了物质除杂的实验方法,除杂问题是化学实验中的一类重要问题,除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,把握好此原则需要我们有扎实的基础知识和缜密的思维. |


科目:高中化学 来源: 题型:
下列离子方程式书写错误的是( )
A.将稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.将NaOH溶液中滴入几滴NH4Cl:NH4++OH-=NH3↑+H2O
C.将少量铜屑放入浓硝酸中:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
D.将氨通入盐酸中: NH3+ H+=NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA
B.1 mol·L-1的碳酸钠溶液中含有CO32-的数目小于NA
C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA
D.1molNa被完全氧化生成Na2O2,失去个2 NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和CO2的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
|
| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.使用分光光度计,可以换算得到某溶液的浓度
B.氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的 NaCl溶液,往阴极室注入稀氢氧化钠溶液
C.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
D.1fs(飞秒)=10-12s(秒)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于化学反应方向的确定,下列说法正确的
A.反应的焓变是决定反应能否自发进行的唯一因素
B.温度、压强一定时,放热反应能自发进行
C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
D.固体的溶解过程与焓变无关
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂。下列说法中正确的是
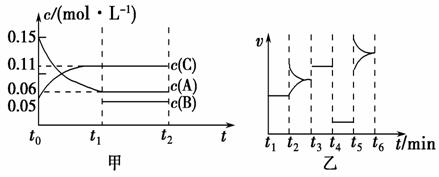
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B. t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g) B(g)+2C(g)ΔH=-50a kJ·mol-1
B(g)+2C(g)ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是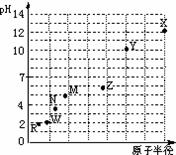
A气态氢化物的稳定性:M>N
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.X和W形成的常见化合物阴阳离子个数比为1:2
D.Z和R组成的化合物是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com