
【题目】(11分)(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况下),实验记录如下(累计值):

① 哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大_______。
②2~3分钟时间段以盐酸的浓度变化来表示的该反应速率______。(设溶液体积不变)
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液,你认为可行的是_____。
(2)将等物质的量A、B混合于2L密闭容器中,发生如下反应3A(g)+B(g)=xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,此时A的浓度与B的浓度之比为3:5,C的平均反应速率是0.1mol/(L·min) 则平衡时A的浓度为__________mol/L,B的平均反应速率mol/(L·min)。
(3)已知断裂1molC-H,O=O,C=O,H-O化学键所需能量分别为akJ,bkJ,ckJ,dkJ,则该反应CH4+O2=CO2+2H2O的反应热为△H=________kJ/mol。
【答案】(1)①2~3min (1分) ②0.1mol/(L·min)(2分,不写单位或单位错扣1分) ③AB(2分,选对一个选项给1分,错选0分) (2)0.75;0.05(每空2分) (3)4a+b-2c-4d(2分)
【解析】
试题分析:①从表中数据看出2 min~3 min收集的氢气比其他时间段多,虽然反应中c(H+)下降,但主要原因是Zn置换H2的反应是放热反应,温度升高;
②在2~3min时间段内,n(H2)=0.112L÷22.4L/mol=0.005mol,由2HCl~H2得,消耗盐酸的物质的量为0.01mol,则υ(HCl)=![]() =0.1 mol/(Lmin);
=0.1 mol/(Lmin);
③A、加入蒸馏水,溶液的浓度减小,反应速率减小,H+的物质的量不变,氢气的量也不变,A正确;B、加入氯化钠溶液,减小盐酸的浓度,反应速率减小,H+的物质的量不变,氢气的量也不变,B正确;C、加入NaNO3溶液,减小盐酸的浓度,但此时溶液中含有硝酸,与金属反应得不到氢气,C错误;D、加入CuSO4溶液,锌能置换出铜,锌、铜、稀盐酸形成原电池,加快了化学反应速率,氢气的量不变,D错误;E、加入Na2CO3溶液,Na2CO3能与盐酸反应,盐酸的浓度减小,反应速率减小,H+的物质的量减小,氢气的量也减小,E错误,答案选AB。
(2)经5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min) ,则生成C是0.5mol/L,所以根据浓度变化量之比是化学计量数之比可知x=2
3A(g)+B(g)=2C(g)+2D(g)
起始量(mol) n n 0 0
转化量(mol) 1.5 0.5 1 1
平衡量(mol) n-1.5 n-0.5 1 1
此时A的浓度与B的浓度之比为3:5
则(n-1.5):(n-0.5)=3:5
解得n=3
因此平衡时A的浓度为![]() =0.75mol/L
=0.75mol/L
平衡时C的平均反应速率是0.1mol/(L·min)
则根据反应速率之比是相应的化学计量数之比可知B的平均反应速率为0.05mol/(L·min)。
(3)反应热=反应物中键能之和-生成物中键能之和,则根据方程式CH4+O2=CO2+2H2O可知该反应的反应热为△H=(4a+b-2c-4d)kJ/mol。


科目:高中化学 来源: 题型:
【题目】下列有关有机物结构、性质的分析正确的是
A. 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同
B. 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键
C. 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化
D. 乙醇在铜催化作用下,能发生还原反应生成乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选修3——物质结构与性质]
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为: I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子的电子排布式为_____________,其第一电离能比Z元素原子的第一电离能________(填“高”或“低”)
(2)X的氯化物的熔点比Q的氯化物的熔点_______________(填“高”或“低”),理由是___________________
(3)光谱证实元素W的单质与强碱性溶液反应有W(OH)4]-生成,则W(OH)4]-中存在_______(填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_________;晶体中每个镁原子周围距离最近的R原子有___________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热,观察到的现象是( )
A. 剧烈燃烧 B. 发出耀眼白光 C. 熔化的铝滴落 D. 失去金属光泽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H6O5的有机物A有如下性质( )
①1mol A+2mol NaOH→正盐,②A+RCOOH或ROH![]() 有香味的物质(R为烃基),③1mol A
有香味的物质(R为烃基),③1mol A![]() 1.5mol气体,④A的分子内脱水产物(不是环状化合物)可使溴水褪色.
1.5mol气体,④A的分子内脱水产物(不是环状化合物)可使溴水褪色.
根据以上信息,对A的结构判断错误的是( )
A.肯定没有碳碳双键
B.有两个羧基
C.肯定有醇羟基
D.有RCOOR'结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:
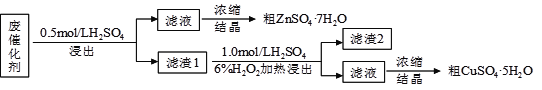
已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的___________(填标号)。

(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下: 。
(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作 。
(4)写出第二次浸出的化学反应方程式 ,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加 。
(5)滤渣2的主要成分是 。浓缩、结晶得到硫酸锌晶体的主要仪器名称是 。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万。下图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是

A.它是由四种元素组成的有机高分子化合物
B.每个丙氨酸分子中含有13个原子核
C.丙氨酸分子中含有3个碳原子
D.丙氨酸分子中氮、氧元素的质量比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】amolNa2O2和bmolNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排除的O2和H2O的物质的量之比为1:1时,a:b为
A.1:1 B.1:2 C.2:3 D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com