
【题目】现有下列4种物质:①金属钠、②水、③氧气、④氯气。其中,从物质分类角度看,与其他物质不属于同类的1种是______(填序号,下同);相互之间可发生置换反应的2种物质是______;其中,______ 2种物质相互反应时,在常温和加热条件下分别可得到不同的产物;______ 2种物质发生的反应不属于4种基本反应类型。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子中化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )

A.和金属钠作用时,键①断裂
B.燃烧是全部化学键都断裂
C.在铜催化下和氧气反应时,键①和③断裂
D.和乙酸、浓硫酸共热时,键②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·(L·min)-1
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2mol·(L·min)-1
C.反应至6 min时,c(H2O2)=0.30 mol·L-1
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
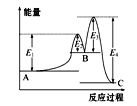
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的能量变化
D.整个反应中能量变化:ΔH=E1-E4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系(反应中生成的水已略去)。
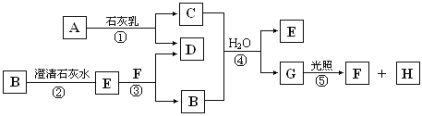
请回答以下问题:
(1)E是 (填化学式),G是 (填名称);
(2)C物质在日常生活中可作 ;
(3)写出反应①的化学方程式 ;
C与浓盐酸反应,可以生成A气体,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.NO2、Cl2O7都是酸性氧化物
B.水银、水玻璃都是混合物
C.HD、HCHO都是化合物
D.干冰、可燃冰都是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
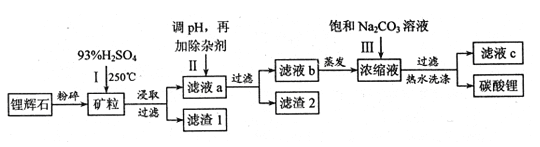
已知①2LiAlSi2O6+H2SO4![]() Li2SO4+Al2O34SiO2H2O
Li2SO4+Al2O34SiO2H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.7、9.0和11.1
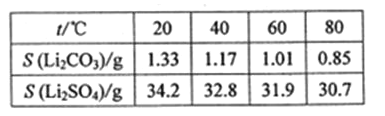
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的pH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液pH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(g)N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是
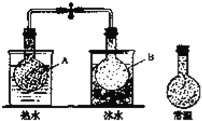
A. 上述过程中,A烧瓶内正、逆反应速率均加快
B. 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C. 上述过程中,A、B烧瓶内气体密度均保持不变
D. 反应2NO2(g)N2O4(g)的逆反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com