
| A. | 丙烯分子有7个σ键和1个π键 | |
| B. | 丙烯分子中有3个碳原子在同一直线上 | |
| C. | 丙烯分子中3个碳原子都是sp3杂化面上 | |
| D. | 丙烯分子存在非极性键 |
分析 A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
B.由C=C双键为平面结构、甲基为四面体结构分析;
C.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
D.同种非元素之间形成非极性键.
解答 解:A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A错误;
B.由C=C双键为平面结构、甲基为四面体结构可知,丙烯分子中2个碳原子在同一直线,故B错误;
C.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,则丙烯分子中1个碳原子是sp3杂化,2个碳原子是sp2杂化,故C错误;
D.同种非元素之间形成非极性键,则丙烯中存在C-C非极性共价键,故D正确.
故选D.
点评 本题考查共价键及分类,为高频考点,侧重于学生的分析能力的考查,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaC12$\frac{\underline{\;电解\;}}{\;}$2Na+C12↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
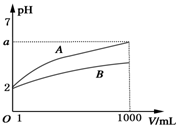 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )| A. | 稀释后A溶液的酸性比B溶液弱 | |
| B. | a=5时,A是强酸,B是弱酸 | |
| C. | 若A、B都是弱酸,则5>a>2 | |
| D. | A、B两种酸溶液物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ①②⑤⑦ | C. | ①②④⑤⑦ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO4→Na2SiO3 | B. | Fe→FeCl2→FeCl3→Fe(OH)3 | ||
| C. | Na→Na2CO2→Na2O2→NaOH | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com