
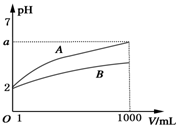
 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )| A. | 稀释后A溶液的酸性比B溶液弱 | |
| B. | a=5时,A是强酸,B是弱酸 | |
| C. | 若A、B都是弱酸,则5>a>2 | |
| D. | A、B两种酸溶液物质的量浓度一定相等 |
分析 由图可知,稀释相同的倍数,A的变化大,则A的酸性比B的酸性强,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+),以此来解答.
解答 解:A.由图可知,稀释后,B的pH小,c(H+)大,则B酸的酸性强,故A正确;
B.由图可知,若a=5,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故B正确;
C.若A、B都是弱酸,则稀释后溶液的pH:5>a>2,故C正确;
D.因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,故D错误;
故选D.
点评 本题考查酸的稀释及图象,题目难度中等,侧重于学生的分析能力的考查,明确强酸在稀释时pH变化程度大及酸的浓度与氢离子的浓度的关系是解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
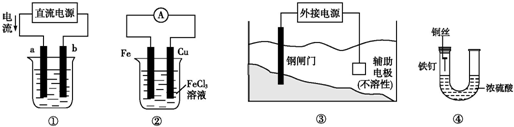
| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键和1个π键 | |
| B. | 丙烯分子中有3个碳原子在同一直线上 | |
| C. | 丙烯分子中3个碳原子都是sp3杂化面上 | |
| D. | 丙烯分子存在非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别同时滴入等浓度的盐酸,放出气体NaHCO3比Na2CO3快 | |
| B. | 热稳定性Na2CO3<NaHCO3 | |
| C. | 常温时水溶性Na2CO3<NaHCO3 | |
| D. | 相对分子质量Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,X与Y 的浓度相等 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 若升高温度Y的转化率减小,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片、石墨棒,稀硫酸 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com