
在25℃时,甲、乙两个烧杯中分别盛有1 L、pH均为2的盐酸和醋酸,现分别投入0.12 g镁粉充分反应,下列说法中,正确的是
| A.反应过程中,两个烧杯中产生氢气的速率一直相等 |
| B.反应结束后,两个烧杯中产生氢气的物质的量相等 |
| C.反应结束后,乙烧杯中有镁粉剩余 |
| D.反应结束后,甲烧杯中溶液呈中性 |
B
解析试题分析:盐酸是强酸,则pH=2的盐酸溶液的浓度是0.01mol/L,因此溶液中氢离子的物质的量是0.01mol。醋酸是弱酸,存在电离平衡CH3COOH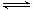 CH3COO-+H+,所以pH=2的醋酸溶液的浓度大于0.01mol/L。金属镁的物质的量是0.12g÷24g/mol=0.005mol,所以镁与盐酸反应时二者恰好反应,与醋酸反应时镁是不足的。A、醋酸是弱酸,在反应过程中不断电离出氢离子,因此反应过程中,两个烧杯中产生氢气的速率是醋酸的大于盐酸的,A不正确;B、反应结束后,两个烧杯中产生氢气的物质的量相等,都是0.005ml,B正确;C、反应结束后,甲烧杯中有镁粉剩余,C不正确;D、反应结束后,甲烧杯中生成的氯化镁水解,溶液显酸性,D不正确,答案选B。
CH3COO-+H+,所以pH=2的醋酸溶液的浓度大于0.01mol/L。金属镁的物质的量是0.12g÷24g/mol=0.005mol,所以镁与盐酸反应时二者恰好反应,与醋酸反应时镁是不足的。A、醋酸是弱酸,在反应过程中不断电离出氢离子,因此反应过程中,两个烧杯中产生氢气的速率是醋酸的大于盐酸的,A不正确;B、反应结束后,两个烧杯中产生氢气的物质的量相等,都是0.005ml,B正确;C、反应结束后,甲烧杯中有镁粉剩余,C不正确;D、反应结束后,甲烧杯中生成的氯化镁水解,溶液显酸性,D不正确,答案选B。
考点:考查弱电解质的电离、反应速率、溶液酸碱性判断以及金属与酸反应的计算


科目:高中化学 来源: 题型:单选题
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,[H+]减小 |
| C.再加入10mL pH="11" NaOH溶液,混合液pH=7 |
| D.溶液中由水电离出的[H+]=1×10-11 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,下列有关溶液的说法正确的是
| A.0.1mol/L的盐酸溶液中由水电离的c(H+)=10—13mo1?L—l |
| B.Na2CO3溶液中加入少量Ca(OH)2固体,CO32—水解程度减小,溶液的pH减小 |
| C.CuSO4溶液蒸干得到Cu(OH)2固体 |
| D.等体积pH=3的醋酸溶液和pH=11的NaOH溶液相混合pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.其溶液的pH=13 |
| B.加入少量NaOH,溶液中c(NH4+)减小,Kw减小 |
| C.与AlCl3溶液反应的离子方程式为 Al3++3OH―=Al(OH)3↓ |
| D.滴加0.10 mol·L-1HNO3溶液到pH=7,溶液中离子浓度关系为:c (NO3―) = c(NH4+)> c(H+)=c(OH―) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实中能说明亚硝酸是弱电解质的是
| A.用HNO2溶液作导电试验,灯光较暗 |
| B.HNO2是共价化合物 |
| C.亚硝酸不与氯化钠反应 |
| D.常温下0.1 mol?L-1亚硝酸溶液的c(H+)为7.1×10-3 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下有下列四种溶液:①0.1 mol/L氨水 ②0.1 mol/L NH4Cl溶液 ③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L ④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是
| A.②③④① | B.②①③④ | C.③②④① | D.③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是:①Na2CO3溶液;②NaHSO4溶液;③NaCl溶液;④AlCl3溶液
| A.①<②<③<④ | B.①<③<④<② |
| C.②<④<③<① | D.④<③<②<① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,满足下列条件的溶液一定呈酸性的是
A.pH 的某物质的水溶液 的某物质的水溶液 | B.加酚酞后显无色的溶液 |
| C.能与金属Al反应放出H2的溶液 | D. 的任意物质的水溶液 的任意物质的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B.常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+) >c(CH3COO-) >c(H+)>c(OH-) |
| C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D.常温下,某溶液中有水电离出的c(H+)=10-51mol·L-1,则此溶液可能是盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com