
【题目】有![]() 、
、![]() 、
、![]() 三种晶体,分别由
三种晶体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 |
| 801 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| 3500 | 很大 | 不溶 | 不导电 | 不反应 |
|
| 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为![]() ______;
______;![]() ______。
______。
(2)晶体的类型分别为![]() ______;
______;![]() ______,
______,![]() ______。
______。
(3)![]() 、
、![]() 晶体中粒子间的作用力分别为______、______。
晶体中粒子间的作用力分别为______、______。
【答案】![]()
![]() 离子晶体 原子晶体 分子晶体 离子键 共价键
离子晶体 原子晶体 分子晶体 离子键 共价键
【解析】
A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成。根据A的水溶液与Ag+反应有白色沉淀,说明A的水溶液中有Cl-,再根据其可以导电得A为NaCl或HCl,又因为其硬度较大,熔点较高,所以A为NaCl;根据B的熔点很高、硬度很大、不导电、不溶于水,可判断其应该为原子晶体,所以B为金刚石;根据C的熔点很低、硬度很小,液态不导电,判断其为气体,易溶于水,水溶液与Ag+反应有白色沉淀,所以C为HCl;结合物质的组成和性质分析解答。
(1)由以上分析可知,A为NaCl,B为金刚石(C),C为HCl,故答案为:NaCl;HCl;
(2)A的熔点较高,熔融状态下能导电,为离子晶体;B的熔点很高、硬度很大、不导电、不溶于水,为原子晶体;C熔点很低、硬度很小,为分子晶体,故答案为:离子晶体;原子晶体;分子晶体;
(3)A为NaCl,NaCl为离子化合物,晶体中粒子间的作用力为离子键;B为金刚石(C),金刚石为原子晶体,原子间以共价键结合,故答案为:离子键;共价键。


科目:高中化学 来源: 题型:
【题目】I.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________;
(2)实验③中的现象为_____;
(3)实验①中反应的离子方程式是_________________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为___。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
Ⅱ.某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+、Cu2+、Fe3+、 Al3+、Fe2+ |
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)③中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将③中红棕色气体(标况下)收集满一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
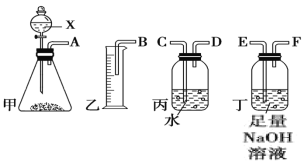
(1)实验室制乙炔的化学反应方程式_____________________________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用________________;
(4)装置丁的作用是____________________
(5)如果乙中收集到水的体积为V mL,电石质量为m g,则电石的纯度为_____________。(体积已换算成标准状况下体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
4NH3(g)+5O2(g)  4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH2=-114.2 kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ΔH3=-71.7kJ/mol
回答下列问题:
(1)NH3(g)+2O2(g)=HNO3(aq)+H2O(l)的ΔH=___________kJ/mol。
原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是________。
(2)研究表明2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g) ![]() N2O2(g)(快) (b)N2O2(g)+O2(g)
N2O2(g)(快) (b)N2O2(g)+O2(g) ![]() 2NO2(g) (慢)
2NO2(g) (慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的_____(填“大”或“小”)。
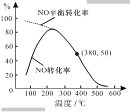
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如右图,则150℃时,v正____v逆(填“>”或“<”)。若起始c(O2)=5.0×104mol·L1,则380℃下反应达平衡时c(O2)=_______ mol·L1。
(3)T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+O2=2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
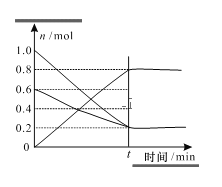
①下列说法能表明该反应已经达到平衡状态的是_______(填序号)
A.混合气体的密度不变
B.混合气体的颜色不变
C.k正、k逆不变
D.2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=___________。
③温度为T1时的化学平衡常数K=_________。若将容器的温度变为T2时k正=k逆,则T2 _______T1(填“>” “<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20世纪90年代末,科学家发现碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
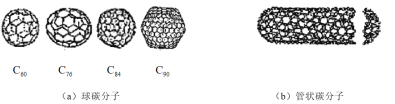
A.金刚石和石墨的熔点肯定比![]() 高
高
B.熔点:![]()
C.球碳分子、管状碳分子和洋葱状碳分子都是分子晶体,都是碳的同素异形体
D.金刚石以非分子形式的粒子存在,属于原子晶体;![]() 、
、![]() 、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大,B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素原子中半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍。请回答下列问题。
(1)画出F的原子结构示意图:__。
(2)B、C、E的简单离子的半径由大到小的顺序为__(用离子符号表)。
(3)在加热条件下,B的常见单质与C的单质发生反应,将所得产物溶于水时所发生反应的化学方程式为__。
(4)D的单质能与C的最高价氧化物对应水化物的溶液反应生成无色气体,该反应中的氧化剂为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:___。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。

①此装置中爱迪生蓄电池的负极是___(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是___。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com