
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:___。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。

①此装置中爱迪生蓄电池的负极是___(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是___。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式___。
【答案】O2+4e-+2H2O=4OH- a 氧化反应 Fe-6e-+8OH-=FeO42-+4H2O
【解析】
(1)钢铁在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(2)①放电时,铁作负极,碳棒作正极,所以放电时a是负极,b是正极;充电时,氢氧化镍失电子发生氧化反应生成氧化镍;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水。
(1)钢铁在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子发生还原反应生成水,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(2)①放电时,铁作负极,碳棒作正极,所以放电时a是负极,b是正极;充电时,氢氧化镍失电子生成氧化镍,发生氧化反应,故答案为:a;氧化反应;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 三种晶体,分别由
三种晶体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 |
| 801 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| 3500 | 很大 | 不溶 | 不导电 | 不反应 |
|
| 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为![]() ______;
______;![]() ______。
______。
(2)晶体的类型分别为![]() ______;
______;![]() ______,
______,![]() ______。
______。
(3)![]() 、
、![]() 晶体中粒子间的作用力分别为______、______。
晶体中粒子间的作用力分别为______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。镧 (La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,有 关其说法正确的是

A.属于金属晶体
B.该合金的化学式为 La7Ni12
C.其熔点比组分金属高,硬度比组分金属大
D.设该结构单元的体积为 Vcm3,NA 为阿伏伽德罗常数,合金的摩尔质量为 M g/mol。则该合金的密度为ρ= ![]() g/ cm3
g/ cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素. 铁、钴、镍都是很好的配位化合物形成体.
(1)[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。H2O 和 N H3 中与 Co2+配位能力较强的是_____,[Co(H2O)6]2+中 Co2+的配位数为___;从轨道重叠方式看,NH3 分子中的化学键类型为___ , H2O 分子的立体构型为___。
(2)铁、镍易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数 遵循 18e-规则。如:Fe(CO)5,则镍与 CO 形成的配合物化学式为_________。常温下 Fe(CO)5 为 黄色油状液体,则 Fe(CO)5 固态为_____晶体。Fe(CO)5 晶体中存在的作用力有___,写出与 CO 互为等电子体的一种阴离子的离子符号_____,Fe(CO)5 中σ键和π键数目之比为______。
(3)一种铁单质其晶胞与钠、钾晶胞相同,如果该铁单质的晶胞参数为 a cm,则相距最近的两 个铁原子核间距为_____cm (用含 a 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(i)CH4(g)+CO2(g)![]() 2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
(ii)CO(g)+2H2(g)![]() CH3OH(g) △H2=﹣90.1kJ·mol﹣1
CH3OH(g) △H2=﹣90.1kJ·mol﹣1
(iii)2CO(g)+O2(g)![]() 2CO2(g) △H3=﹣566.01kJ·mol﹣1
2CO2(g) △H3=﹣566.01kJ·mol﹣1
用CH4和O2直接制备甲醇蒸气的热化学方程式为___。
(2)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像正确的是
A. 向氢氧化钙和氢氧化钠混合溶液中通入二氧化碳
B. 用氢氧化钠溶液滴定等浓度的盐酸和醋酸
C. 向氢氧化钠溶液中通入二氧化碳
D. 氯化氢和氯气的混合气体通入氢氧化钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
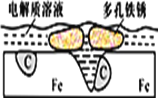
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图:
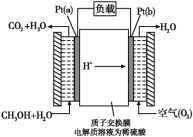
请回答下列问题:
(1)Pt(a)电极反应为________;如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有________mol。
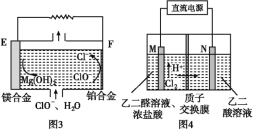
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式________。
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛(OHC—CHO)与M电极的产物反应生成乙醛酸。
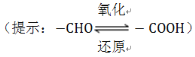
①N电极上的电极反应式为________。
②若2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某常见微粒X的结构模型可表示为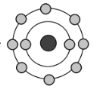 (
(![]() 代表电子),下列有关X的说法正确的是( )
代表电子),下列有关X的说法正确的是( )
A.微粒X的组成元素不可能是第三周期元素
B.X的组成元素一定是氖元素
C.若X的组成元素原子的核电荷数为8,则X是![]()
D.若X的核内质子数比电子数多,则X最多有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com